高三化学第一学期摸底考试
相对原子质量:Mg 24 Cl 35.5 C 12 N 14 O 16 H 1 Cu 64 Na 23 Fe 56
第 Ⅰ 卷 ( 共66分)
一、选择题(本题包括5小题,每小题只有一个选项符合题意)
1.食品有多种分类方法,其中之一可以把食品分为绿色食品、蓝色食品、白色食品等.绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品,下面属于白色食品的是 ( )
A.食醋 B.海带 C.面粉 D.花生油
2.海湾战争中,科威特大批油井着火,在灭火工作中,下列措施不能考虑用于灭火的是 ( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法降低石油着火点 D.设法使火焰隔绝空气
3.下列各组微粒,氧化性由强到弱顺序排列的是 ( )
A.F2、C12、Br2、I2 B.Cu、Fe、Al、Mg
C.Cu2+、H+、Zn2+、Fe2+ D.F-、C1-、Br-、I-
4.有体积相同的两份营养液其配方如下:
| KCl |
|
|
| |
| 第一份 | 0.3mol | 0.2mol | 0.1mol | — |
| 第二份 | 0.1mol | 0.3mol | — | 0.1mol |
两份营养液中各离子浓度 ( )
A.完全相同 B.完全不同
C.仅[![]() ]相同 D.仅[
]相同 D.仅[![]() ]相同
]相同
5.充分燃烧一定量的丁烷(C4H10)放出热量为Q,经测定完全吸收它生成的CO2需消耗5mol/LKOH溶液100mL,恰好生成正盐。则燃烧1mol丁烷放出的热量为 ( )
A.4Q B.5Q C.8Q D.16Q
二、选择题(本题包括12个小题,共36分。每小题只有一个选项符合题意)
6.区别电解质强弱的合理依据是 ( )
A. 溶液的导电能力 B. 一定浓度时的电离程度
C. 水溶性大小 D. 与酸或碱反应时消耗酸或碱的量翰林汇
7.翰林汇。某无色透明溶液中,由水电离出来的c(H+)=1×10-3mol/L,在该溶液中一定能够大量共存的离子组是 ( )
A.K+、Na+、MnO4-、NO3- B.Fe3+、A13+、Cl-、HS-
C.NH4+、A1O2-、Na+、CH3COO- D.K+、Na+、SO42-、NO3-
8.下列离子方程式正确的是 ( )
A.FeS和稀硝酸反应 FeS+2H+→Fe2++H2S↑
B. 溴化亚铁溶液中通入过量氯气 2Fe2++4Br-+3C12→2Fe3++6Cl-+2Br2
C.钠与水反应 Na+2H2O→Na++2OH-+H2↑
D.碳酸氢钙溶液与过量氢氧化钠溶液反应Ca2++HCO3-+OH-→CaCO3↓+H2O
9.下列说法正确的是 ( )
A.强极性键形成的化合物不一定是强电解质
B.强电解质溶液的导电能力一定比弱电解质溶液强
C.NaCl溶液在电流的作用下电离成钠离子和氯离子
D.氯化钠晶体不导电是由于氯化钠晶体中不存在离子
10.已知化合物A(![]() )与立方烷(
)与立方烷(![]() )的分子结构相似,如下图:
)的分子结构相似,如下图:
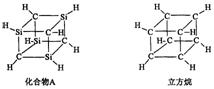
则![]() 的二氯代物的同分异构体数目为
( )
的二氯代物的同分异构体数目为
( )
A.3 B.4 C.5 D.6
![]() 11.已知:298K时,2SO2(g)+O2(g) 2SO3(g)+197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
11.已知:298K时,2SO2(g)+O2(g) 2SO3(g)+197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
12.水杨酸的结构简式为![]() 它与下列那一物质的溶液反应可得一种钠盐,其分子式为C7H5O3Na。
( )
它与下列那一物质的溶液反应可得一种钠盐,其分子式为C7H5O3Na。
( )
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
13.脑白金的主要成分的结构简式为: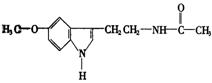 下列对脑白金主要成分的推论错误的是
( )
下列对脑白金主要成分的推论错误的是
( )
A.其分子式为![]() B.能水解生成乙酸
B.能水解生成乙酸
C.能与溴水发生加成反应 D.其营养成分及官能团与葡萄糖相同
14.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵(NH4Ac)溶液形成无色溶液,其化学方程式是PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4,当在醋酸铅(Pb(Ac)2)溶液中通入弱电解质H2S时,有黑色沉淀PbS生成.表示这个反应的有关离子方程式正确的是 ( )
A.Pb(Ac)2+H2S=PbS↓+2HAc B.Pb2++H2S=PbS↓+2H+
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
15.一种化学冰袋中含有![]() (96g)、
(96g)、![]() (50g)、
(50g)、![]() (40g)、
(40g)、![]() (40g).将
(40g).将![]() 和其他3种盐分盛于2只塑料袋中,用时使它们混合并用手搓揉就可致冷,致冷效果能维持2h~3h.以下关于其致冷原因的猜测肯定错误的是
( )
和其他3种盐分盛于2只塑料袋中,用时使它们混合并用手搓揉就可致冷,致冷效果能维持2h~3h.以下关于其致冷原因的猜测肯定错误的是
( )
A.![]() 脱水是吸热过程
脱水是吸热过程
B.较长时间致冷是由于![]() 脱水是较慢的过程
脱水是较慢的过程
C.铵盐在该条件下发生复分解反应是吸热反应
D.![]() 溶于结晶水中会吸收热量
溶于结晶水中会吸收热量
16.在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
17.已知0.1mol/L HCN溶液的PH=4,0.1mol/L NaCN 溶液的PH=12,先将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后,溶液中各离子浓度间的关系正确的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
三、选择题(本题包括5个小题,共20分。每小题有1-2个选项符合题意)
18.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 ( )
A.标准状况下,2.24L苯中约含有3.612×102:个碳原子
B.常温常压下,氧气和臭氧的混合物16s中约含有6.0Q×1O23个氧原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
19.同浓度,同体积的下列物质后者滴入前者的过程中,溶液的导电性变化不大 ( )
A.氨水,盐酸 B.硫酸镁,氢氧化钠
C.氢氧化钡,盐酸 D.氢氧化钡,硫酸铜
20.某种一元酸(HA)溶液中,加入一定量的一种强碱(MOH)溶液后恰好完全反应,则有关反应后溶液的判断中,一定正确的是 ( )
A.c(A-)≤c(M+) B. c(A-)≥c(M+)
C.若MA不水解,则c(OH-) <c(A-) D.若MA不水解,则c(OH-) >c(A-)
21.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol/LKHC2O4溶液中,下列关系正确的是( )
A c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B c(HC2O4-)+c(C2O42-)=0.1mol·L-1
C c(C2O42-)>c(H2C2O4)
D c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
22.将镁在空气中燃烧的全部产物溶解在80毫升浓度为2.375摩/升盐酸中,以40毫升0.9摩/升氢氧化钠溶液中和多余盐酸。然后再加入过量的氢氧化钠溶液,把生成的NH3用盐酸全部吸收,经测定氨为0.646克,则燃烧掉镁的质量为: ( )
A. 3.46g B. 2.59g C. 1.392g D. 1.68g
第 Ⅱ 卷 (非选择题 共84分)
 三、(本题包括3小题,共xxx分)
三、(本题包括3小题,共xxx分)
23.在一定条件下,二氧化碳和氧气发生如下反应:
![]() 2SO2(g)+ O2
(g) 2SO3(g)
+ Q (Q>0)
2SO2(g)+ O2
(g) 2SO3(g)
+ Q (Q>0)
(1)写出该反应的化学平衡常数表达式 K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度 (以上均填增大、减小或不变)
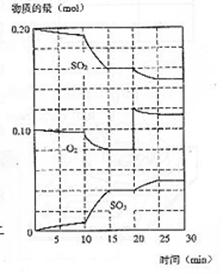
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
24.化学电池在通讯、交通及日常生活中有着广泛的应用,目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
![]()
![]()
![]()
(1)下列有关镍镉电池总反应的说法中,正确的是________(填序号);
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
(2)已知![]() 和
和![]() 均难溶于水.有资料表明,一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为____________________ ;
均难溶于水.有资料表明,一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为____________________ ;
(3)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为:![]() .试回答:
.试回答:
①锂电池比容量特别大的原因是_____________________________________________ ;
②锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_______________________________________.
25.下列有两小题分别为a、b,请你任选一小题回答,如两题多答,只按a题给分)
a.碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
(1)在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
| 时间 | 起始 | 14min后 | 30min后 | 75min后 |
| pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化?为什么?
(2)观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
(3)上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质?为什么此时会有沉淀析出?
b. BiCl3水解生成BiOCl(难溶)。
⑴写出水解反应的方程式___________________________________________。
⑵医药上把BiOCl叫做次氯酸铋。你同意此名称吗?_________。理由是_______ 。
⑶如何配制BiCl3溶液?答:________________________________________________ 。
⑷把适量固体BiCl3置于NaCl溶液可得澄清溶液,请说出可能的原因。答__________ 。
四、推断题
26.已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光,在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与氢气之密度比约为8.5。
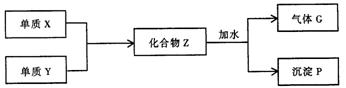
(1)组成单质X和Y的元素分别属第________族和第________族。
(2)化合物Z的化学式为________________。
(3)每生成1mol的气体C,同时应得到________mol的沉淀P。
![]() 27.已知CH2
27.已知CH2 CH—CH CH2在不同条件下可与1molBr2发生反应,得到两种不同产物:
![]() ①CH2
①CH2 CH—CH CH2+Br2
CH2 CH—CH—CH2
![]() ②CH2
②CH2 CH—CH CH2+Br2
CH2—CH CH—CH2
![]() 又知炔和烯均可被酸性KMnO4氧化成羧酸:
又知炔和烯均可被酸性KMnO4氧化成羧酸:
![]() R—CH
R—CH CH—R′
R—COOH+R’—COOH
R—C≡C—R′ R—COOH+ R’—COOH
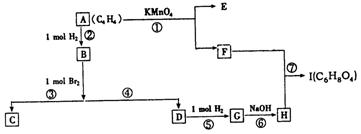
下图方格中每格均代表一种物质,从起始物A(C4H4,一种链烃)最终可得酯I(C6H8O4是具有六原子环的环状酯)。
|
(1)写出下列物质的结构简式:E , I 。
(2)以上各反应中属于取代反应的有 (填序号)。
(3)反应⑥的化学方程式为 。
28.已知①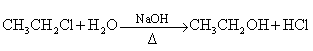
②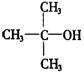 不能氧化为醛或羧酸.
不能氧化为醛或羧酸.
PMAA是一种“智能型”大分子,可应用于生物制药中大分子和小分子的分离.下列是以A物质为起始反应物合成PMAA的路线:
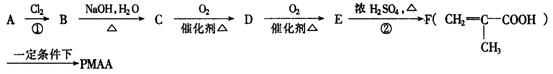
(1)分别写出A和PMAA的结构简式A________________________;PMAA_________________.
(2)上述反应过程中①②的反应类型分别是①___________________;②_________.
(3)写出E→F的化学方程式________________________________
五、实验题
28.实验室可通过多条途径得到氮气,常见的三种方法是:
方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜.
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末.
方法三,将亚硝酸钠(![]() )和氯化铵的混合溶液加热,逸出氮气.
)和氯化铵的混合溶液加热,逸出氮气.
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
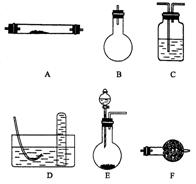
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)________作发生装置,该反应的化学方程式_________________________________要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)_____________________.
(2)在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用.这两种方法与方法三相比,其优越性在于___________________________________ .
六、计算题
30.有![]() 和CO的混合气体0.5mol在足量
和CO的混合气体0.5mol在足量![]() 中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量
中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量![]() 吸收,
吸收,![]() 增重15g.
增重15g.
(1)写出燃烧后的产物与![]() 反应的化学方程式.
反应的化学方程式.
(2)原混合气体![]() =______L,
=______L,![]() =______L(标准状况下),混合气体的平均相对分子质量为:
=______L(标准状况下),混合气体的平均相对分子质量为:![]() =_______________.
=_______________.
31.已知Fe2O3在高炉中有下列反应:
Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 (选填 a、b、c)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
A%=
请在下图中画出A%和mFe/mO关系的图形。
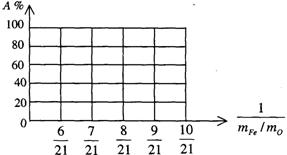
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
| 混和物组成(用化学式表示) | a的取植范围 |