高三化学复习晶体结构
一.选择题(有1~2个正确选项)
1.在离子晶体中不存在的相互作用是 ( )
A.离子键 B.极性键 C.非极性键 D.范德华力
2.下列物质熔化或气化时,不破坏化学键的是 ( )
A.碘 B.氯化镁 C.金刚石 D.干冰
3.在金刚石晶体的网状结构中,含有共价键形成的碳原子环,其中最小的碳环上的碳原子数和碳、碳键的夹角分别是 ( )
A.6个,120° B.6个,109°28′
C.5个,109°28′ D.5个,120°
4.下列各组物质气化或熔化时,可克服的微粒间相互作用属于同种类型的是 ( )
A.碘和干冰升华 B.SiO2和CaO熔化 C.NaCl和Al熔化 D.硫和硅熔化
5.下列物质的熔点顺序排列正确的是 ( )
A.Li<Na<Rb<Cs
B.F2<Cl2<Br2<I2
C.金刚石>晶体硅>碳化硅
D.金刚石>氯化钠>汞
6.石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面的网状结构。如果将每对相邻的原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与碳碳化学键数之比是 ( )
A. 1∶1 B. 1∶2 C. 1∶3 D. 2∶3
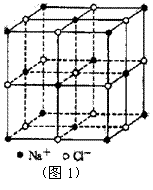
7.食盐晶体如图1所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
 ( )
( )
A. ![]() cm
B.
cm
B. ![]() cm
cm
A. ![]() cm
D.
cm
D. ![]() cm
cm
8.在上题中的NaCl晶体结构示意图(图1)中,与每个Na+距离相等且最近的Cl-所围成的空间几何构型为 ( )
A、正四面体 B、正六面体
C、正八面体 D、正十二面体
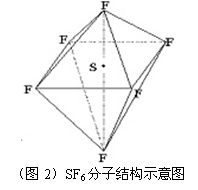
9.SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如图2所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为 ( )
A、6种 B、7种 C、10种 D、12种
 | |||
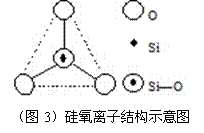 | |||
10.图3所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是 ( )
A、键角为120℃ B、化学组成为SiO32-
C、键角为109°28′ D、化学组成为SiO44-
二.填空题
11.有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为______,属______分子,其晶体类型是______。俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(5)C和D的化合物溶于水后滴入过量KOH,现象是______,离子方程式______。
12.现有八种物质:①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是______;
 (3)属于分子晶体,且分子为直线型结构的是______;
(3)属于分子晶体,且分子为直线型结构的是______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是______;
(6)含有离子键、共价键、配位键的化合物是______。
13.b-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图4。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
 (1) 每个正六边形拥有
个锗原子, 个氧原子。
(1) 每个正六边形拥有
个锗原子, 个氧原子。
(2) 试写出Ge-132的化学式 。
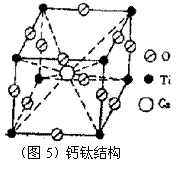
14.如图5为高温超导领域里一种化合物——钙钛矿结构。该结构是具有代表性的最小重复单元。
(1) 在该物质的晶体中,每个钛离子周围与它最接近的且距离相等的钛离子共有 个。
(2) 该晶体结构中,元素氧、钛、钙的原子个数比是 。
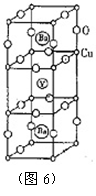
15.1986年在瑞士苏黎世工作的两位科学家发现一种性能很好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的诺贝尔物理学奖。实验测定表明,其晶胞结构如图6所示:
① 根据所示晶胞结构,推算晶体中Y、Cu、Ba和O的原子个数比,确定其化学式 ;
② 根据①所推出的化合物的组成,计算其中Cu元素的平均化合价(该化合物中各元素的化合价为![]() 、
、![]() 、
、![]() 和
和![]() )。试计算化合物中这两种价态Cu离子数之比为
。
)。试计算化合物中这两种价态Cu离子数之比为
。
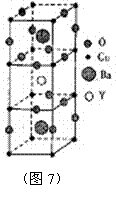
③ 研究表明,当该化合物的组成为YBa2Cu3O7-x(x=0.2)时其超导性最佳。这样的组成是因结构中某些氧原子的位置出现空缺,形成晶体“缺陷”的结果。因这种组成的化合物不能用简单的整数比来表示其化学式,称为非整数比化合物。试通过计算确定化合物中Cu2+与Cu3+原子个数之比为 (缺陷晶体见图7所示)
 |  | ||
三.计算题
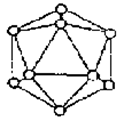 16.右图为晶体硼的基本结构单元,已知它为正二十面体(有二十个等边三角形和一定数目的顶角),每一个顶点各有一个硼原子,通过观察,此基本结构单元由多少硼原子构成?
16.右图为晶体硼的基本结构单元,已知它为正二十面体(有二十个等边三角形和一定数目的顶角),每一个顶点各有一个硼原子,通过观察,此基本结构单元由多少硼原子构成?
答案
一.选择题
1.D 2.AD 3.B 4.A 5.BD
6.D 每个碳原子周围有3个共价键,每个共价键周围有2个碳原子,所以碳原子数与共价键数之比为2︰3
7.B
NaCl晶胞中最小的一个立方体平均占有Na+、Cl—均为4×![]() =
=![]() (个),所以其质量为
(个),所以其质量为![]() g,则体积为
g,则体积为![]() cm3
cm3
8.C 9.C 10.CD
二.填空题
![]() 11. (1)金刚石;原子晶体
11. (1)金刚石;原子晶体
(3)直线型分子;非极性;分子晶体;干冰
(4)3;ⅢA;HClO4>H2CO3>H3AlO3
(5)先有白色沉淀,滴入过量KOH时白色沉淀消失。
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2—+2H2O
12. (1)②④; (2)①③⑧; (3)①; (4)⑧; (5)⑤; (6)⑦
13. (1) 2;3 (2) Ge2C6H10O9
14. (1) 6 (2) 3∶1∶1
15.解析:
①
由图6所示晶胞可知,1个晶胞中有1个Y3+,2个Ba2+。晶胞最上方和最下方分别有4个Cun+,它们分别被8个晶胞所共用;晶胞中间立方体的8个顶点各有1个Cun+,它们分别被4个晶胞共用,因此该晶胞中Cun+的数目为:8×![]() +8×
+8×![]() =3个。晶胞最上方、最下方平面的棱边上共有4个氧离子,分别被4个晶胞共用;又在晶胞
=3个。晶胞最上方、最下方平面的棱边上共有4个氧离子,分别被4个晶胞共用;又在晶胞
上的立方体的竖直棱边上和晶胞下方的立方体的竖直棱边上各有4个氧离子,它们分别被4个晶胞所共用;中间立方体的水平棱边上共有8个氧离子,它们分别被2个晶胞共用,因此该晶胞中氧离子个数为:4×![]() +(4+4)×
+(4+4)×![]() +8×
+8×![]() =7个。
=7个。
所以晶体中Y∶Ba∶Cu∶O=1∶2∶3∶7,化学式为YBa2Cu3O7。
②设Cu的平均化合价为x,由化合物中元素正负化合价代数和为零可得:1×(+3)+2×(+2)+3x+7×(-2)=0,x=+![]() 价,其中,Cu2+∶Cu3+=2∶1。
价,其中,Cu2+∶Cu3+=2∶1。
三.计算题
16. 解析:该晶体的晶胞由二十个等边三角形构成,而每个等边三角形有3个顶点,这样共有20×3=60个顶点,但每个顶点又被相邻的5个等边三角形所共有,所以该晶胞实际拥有的顶点数应为:20×3×![]() =12个
=12个