高考化学总复习检测题
(氮族)
班别 姓名 座号 评分
选择题答题表:
| 题号 | | | | | | | | | | | | | | | | | | |
| 答案 | | | | | | | | | | | | | | | | | | |
一、 选择题(每题只有一个合适答案,有8小题,每小题4分,共32分)
1.下列气体对大气没有污染的是
A 、N2 B、 NO2 C 、NO D、 CO
2、下列广告用语在科学上没有错误的是
A、这种饮料中不含任何化学物质
B、这种蒸馏水绝对纯净,其中不含任何离子
C、这种口服液含丰富的氮、磷、锌等微量元素
D、没有水就没有生命
3、为了除去镀在铝表面的铜镀层可选用的试剂有 ( )
A、 稀HNO3 B、 浓HNO3 C、 浓H2SO4 D 、浓盐酸
4、只用一种试剂就能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4 四种溶液区分开,这种试剂是( )
A 、NaOH 溶液 B 、AgNO3溶液 C、 Ba(OH)2溶液 D 、BaCl2溶液
5、下列各组物质互为同素异形体的是
(A)红磷与白磷 (B)磷酸与偏磷酸 (C)NO2与N2O4 (D)![]() Cl和
Cl和![]() Cl
Cl
6、除去NO气体中的少量NH3,最好选用的试剂是
A.浓H2SO4 B.NaOH溶液 C.稀H2SO4 D.水
7、下列有关含氧酸的对应酸酐不正确的是
(A)HPO3:P2O3 (B)HNO2:N2O3 (C)H4SiO4:SiO2 (D)H3AsO4:As2O5
8、为了客运安全,下列物质①硝铵②硫磺③氯化钾④过磷酸钙⑤氯酸钾⑥硝酸钾⑦白磷⑧汽油,从化学性质上判断,由于易燃易爆不能带上火车的是 ( )
(A)①②④⑥⑧ (B)①⑤⑥⑦⑧ (C)①③⑥⑦⑧ (D)①②⑤⑦⑧
二、选择题(每题有1~2个合适的答案,有10小题,每小题4分,共40分)
9、下列盐溶液中,加入氯化钡溶液生成白色沉淀,再加稀硝酸振荡,白色沉淀不消失的是
(A)NaNO3 (B)AgNO3 (C)Na2CO3 (D)Na2SO3
10、下列物质发生化学反应时,在不同条件下,可得到不同产物的是①P+Cl2②P2O5+H2O
③H2S+O2 ④Na+O2
(A)只有①② (B) 只有③④ (C) 只有②③④ (D)全部
11、既能用浓H2SO4干燥,又能用P2O5干燥的气体是
(A)SO2 (B)H2S (C)NH3 (D)Cl2
12、能说明红磷和白磷是同素异形体的事实是
A、 红磷无毒,白磷有毒
B、 白磷易溶于CS2,红磷不溶于CS2
C、 白磷和红磷充分燃烧后都生成五氧化二磷
D 白磷和红磷在一定条件下可以互变
13、常见的大气污染物分为一次污染物和二次污染物,二次污染物是排入环境的一次污染物在物理化学因素或微生物作用下发生变化所生成的新污染物。如:
2 NO + O2 ======= 2 NO2 ,则NO2 就是二次污染物。下列四种气体: ① SO2 ② NO ③ NO2 ④ Cl2中能导致二次污染的是()
A ①②③ B ③④ C ①②③④ D ②
14、盛有12mLNO气体的试管倒立于水槽中,通入一定量的O2,充分反应后,试管内的气体体积为4mL,则通入O2的体积可能为
A.8mL B.6mL C.11mL D.13mL
15、下列反应的离子方程式错误的是
A将NH3通入H2SO4中 NH3 + H+ ===== NH4+
B 向(NH4)2SO4溶液中滴加Ba(OH)2溶液 Ba2+ + SO42-===== BaSO4↓
C Cu和稀硝酸反应 3Cu + 8 H+ + 2NO3-===== 3Cu2+ + 2NO ↑+ 4H2O
D FeO和稀硝酸 FeO + 2H+ ===== Fe2+ + H2O
16、VCD 光盘上的光记录材料有很多种,它们都可以在激光的照射下发生物理或化学性能的改变,从而储存信息。碲的化合物是常用的一种VCD 光记录材料,对碲元素及其化合物的下列认识,不正确的是
A 碲元素位于元素周期表的第4周期VIA族
B H2TeO4的酸性比HIO4弱
C 碲化氢的化学式为H2Te
D 单质碲在常温下为固体
17、常温常压下,a、b、c、d四支相同的试管中,分别装入以等物质的量混合的两种气体,a试管内是NO2与O2,b试管内为Cl2和SO2,c试管内为NO与O2,d试管内是NH3与N2,将四支试管同时倒立于水中,最终各试管中水面上升高度顺序应为
(A)b>c>a>d (B)b>a>c>d (C)d>b>a>c (D)b>d>c>a
18、硫酸铵可能混有下列物质,将13.2g该硫酸铵在加热条件下跟过量的氢氧化钠溶液反应,可收集到4.3L(标准状况下)气体,则样品内不可能含有的物质是
A、碳酸氢铵和硝酸铵 B、碳酸铵和硝酸铵
C、氯化铵和碳酸氢铵 D、氯化铵和碳酸铵
三、 实验(21分)
19、(3分)有一硝酸钾的溶液,其中混有少量的KBr和KH2PO4。有人拟用硝酸银、碳酸钾、硝酸、氢氧化钾四种试剂除去混有的两种杂质。若规定不得重复使用同一试剂,且加入的试剂均稍过量以保证除尽杂质,最后溶液中只允许含有K+、NO3—、H+,则加入试剂的合理顺序是:__________________。
20、(18分)实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液与NH4Cl饱和溶液共热制取氮气:
NaNO2+NH4Cl=NaCl + NH4NO2
NH4NO2 ![]() N2↑+2H2O。
N2↑+2H2O。
制取装置如图所示:
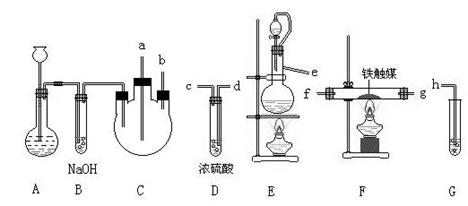
(1)装置A用于制取____
(2)装置E中分液漏斗上方常用导管与圆底烧瓶相通,作用是_________。装置E与装置C直接相连,连接时导管口连接方法为e接____。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:
另一接口___接__ ,__ 接____,_____接_____。
(4)装置D的作用为_________ 。装置F导出的气体的成分为_____________。
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下_____(填“能”或“不能”),理由是_________________。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与_______接为佳。
四、填空(每空2分,共18分)
21、国家大力推广使用无磷洗衣粉,是因为含磷、氮的化合物进入水体中,会造成水体的________________________。
22、酸雨是由于大气中二氧化硫和NOx(NO和NO2)的含量不断升高,并转变为硫酸和硝酸(主要是硫酸)随 雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收二氧化硫,离子方程式为___________________________;
硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱吸收生成NaNO2和NaNO3,离子方程式为 ____________________________;
也可用氨催化还原法把氮的氧化物变成氮气,还原1体积NOx需要 体积氨气。
对酸雨地区的治理,目前一种比较有效的方法是用直升机喷撒白垩粉降解酸雨污染,其离子方程式是 _____________________ , .
23、有一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据①把混合气体通过浓H2SO4时,气体体积明显减小。②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色,可得:混合气体中一定存在 ,一定不存在 ,可能存在 。
五、推断题(每空2分,共18分)
24、某种常见的白色晶体A与盐酸反应,产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加浓Ba(OH)2溶液,则产生白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A可生成水、B和D,而且B与D的物质的量之比为1∶1,据此判断,A 、B、C、D分别是什么物质?并写出有关化学方程式。
六、计算题(共21分)
25、(9分)金属M的硝酸盐受热时按下式分解:2MNO3 = 2M+2NO2↑+O2↑。现加热分解3.40gMNO3,生成NO2和O2的混合气体672mL(标况下)。
(1)求M的相对原子质量
(2)将生成的气体通入足量水中充分反应,最后得到的气体能使带火星的木条复燃,求所得气体在标况下的体积是多少?
26、(12分)8.5 t氨用氧化法制取63%的硝酸,设NH3的转化率为96%,NO转化为HNO3的产率为92%,则实际能得63%的硝酸的质量为几吨?理论上计算消耗空气多少m3(标况)?
氮族参考答案
1.A 2.D 3.B 4.C 5.A 6.A 7.A 8.D 9.BD 10.D 11.AD 12.D 13.C 14.BD 15.BD 16.A 17.B 18.BD 19. KOH AgNO3 K2CO3 HNO3
20. (1)H2 (2)便于液体顺序流下 , b (3)a 接 d , c 接 f ,g 接 h
(4)干燥N2、H2 , NH3、H2、N2 (5)不能 , 氨气极易溶于水而发生倒吸 (6)d相连
21. 富营养化,导致赤潮的发生 22. SO2+2NH3••·H2O=2NH4++SO32-+H2O;
2NO2+2OH—=NO3—+NO2—+H2O;2X/3 ,CaCO3 +2H++ SO42-=CaSO4+CO2↑+H2O ,
CaCO3 +2H+=Ca2++CO2↑ +H2O
23.NH3、CO2、NO,HCl、Cl2、NO2、O2,H2
24. A:碳酸氢氨 B:二氧化碳 C:碳酸钡 D:氨气 化学方程式:略(共5 个)
25.(1) 108 (2)112ml 26. 44.16t 98.9m3