高考化学总复习检测题
(化学反应速率 化学平衡)
班别 姓名 座号 评分
选择题答题表:
| 题号 | | | | | | | | | | | | | | | | | | |
| 答案 | | | | | | | | | | | | | | | | | | |
一.选择题(共8小题,每小题只有一个合适的答案,每小题4分,共32分)
1.一定条件下反应N2(g)+3H2(g)
![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min) C.0.6mol/(L·min) D.0.4mol/(L·min)
2.在2A+3B ![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)= 1 mol·L-1·S-1
3.下列不属于可逆反应的是 ( )
A、氯化铵在试管中加热分解 B、NO2和N2O4在常温下的相互转化
C、SO2和O2在加热条件下的催化反应 D、HI高温分解
4.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO+O2![]() 2NO2
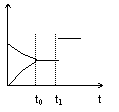
B.N2O4
2NO2
B.N2O4
![]() 2NO2
2NO2
C.Br2(g)+H2 ![]() 2HBr
D.6NO+4NH3
2HBr
D.6NO+4NH3 ![]() 5N2+6H2O
5N2+6H2O
5.在2L的密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是
 A.1.6mol
B.2.8mol C.3.2mol
D.3.6mol
A.1.6mol
B.2.8mol C.3.2mol
D.3.6mol
6.如图是表示:2X+Y ![]() Z+R ; △H=-Q 的气体反应速率(υ)
Z+R ; △H=-Q 的气体反应速率(υ)
与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是 v
A.减少Z物质 B.加大压强
C.升高温度 D.使用催化剂
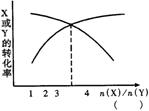 7.一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的量之比[n(X)/n(Y)]的关系如右图,则X和Y反应的方程式可表示为
7.一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的量之比[n(X)/n(Y)]的关系如右图,则X和Y反应的方程式可表示为
A.X+3Y![]() 2Z
B.3X+Y
2Z
B.3X+Y![]() 2Z
2Z
C.3X+2Y![]() Z
D.2X+3Y
Z
D.2X+3Y![]() 2Z
2Z
8.对于密闭容器中进行的反应,CO(g)+H2O![]() CO2(g)+H2(g)达平衡时,其它条件不变,增大CO的浓度,下列说法不正确的是
CO2(g)+H2(g)达平衡时,其它条件不变,增大CO的浓度,下列说法不正确的是
A、正反应速率增大 B、逆反应速率先不变
C、达新平衡时,逆反应速率比原平衡要大 D、逆反应速率先减小后增大
二.选择题(共10小题,每小题可能有1~2个合适的答案,每小题4分,共40分)
9.关于可逆反应H2+I2(气)=2HI达到平衡的标志是
A、 一个H-H键断裂的同时,有一个I-I键断裂
B、 一个H-H键断裂的同时,有二个H-I键生成
C、 一个H-H键断裂的同时,有一个H-I键断裂
D、 一个H-H键断裂的同时,有二个H-I键断裂
10.在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3 ![]() N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
A.3mol H2和1mol N2 B.2mol NH3和1mol N2
B.2mol N2和3mol H2 D.0.1mol NH3、0.95mol N2、2.85mol H2
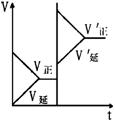 11.对达到平衡的可逆反应X+Y
11.对达到平衡的可逆反应X+Y![]() W+Z,增大压强则正、逆反应速度(v)的变化如右图,分析可知X,Y,Z,W的聚集状态可能是( )
W+Z,增大压强则正、逆反应速度(v)的变化如右图,分析可知X,Y,Z,W的聚集状态可能是( )
A.Z,W为气体,X,Y中之一为气体
B.Z,W中之一为气体,X,Y为非气体
C.X,Y,Z皆为气体,W为非气体
D.X,Y为气体,Z,W中之一为气体
12.2molSO2和1molO2放入密闭容器中发生反应2SO2+O2![]() 2SO3,从反应开始到平衡过程中不可能出现的是
2SO3,从反应开始到平衡过程中不可能出现的是
A、1molSO2、0.5molO2 B、1.8molSO2、0.9molO2
C、0.2molSO2、0.1molO2 D、2molSO3
13.能增加反应物分子中活化分子的百分数的是
A.升高温度 B.使用催化剂 C.增大压强 D.增加浓度
14.反应aA(g)+bB(g) ![]() cC(g);△H=-Q,生成物C的质量分数与压强P和温度的关系如下图,方程式中的化学计量数和Q值符合图象的是( )
cC(g);△H=-Q,生成物C的质量分数与压强P和温度的关系如下图,方程式中的化学计量数和Q值符合图象的是( )
 A.a+b<c Q>0 B.a+b>c Q<0
A.a+b<c Q>0 B.a+b>c Q<0
C.a+b<c Q<0 D.a+b=c Q>0
15.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
A.2 mol SO2 + 1 mol O2 B.4 mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 mol SO3 D.3 mol SO2 + 1 mol O2 + 1 mol SO3
16.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) ![]() 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
 A.67% B.50% C.25%
D.5%
A.67% B.50% C.25%
D.5%
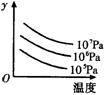
17.某可逆反应L(s)+G(g) ![]() 3R(g);
△H>0,右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g);
△H>0,右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
A.平衡混合气中R的质量分数 B.达到平衡时G的转化率
C.平衡混合气中G的质量分数 D.达到平衡时L的转化率
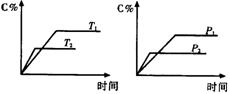
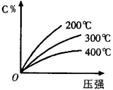 18.反应mA(固)+nB(气)
18.反应mA(固)+nB(气) ![]() eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是( )
A. 到平衡后,加入催化剂则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e+f
D.达到平衡后,增加A的量有利于平衡向右移动
三.实验题
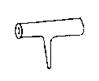 19.实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
19.实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
(1)用此仪器不能反复进行的实验是 (填序号)
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷一定温度下互相转变
D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是 。
(3)如果玻璃管内装有大量红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ,如果玻璃管内封有少量无色溶液,加热溶液时,溶液变红,冷却后恢复无色。此溶液可能是 。
 四、填空题
四、填空题
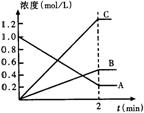
20.右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:(1)该反应的反应物是______。(2)该反应的化学方程式为__________。(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为_______。
21.CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++ 4Cl-![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
(蓝色) (黄色)
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:
①_________ ____________,②_____ _________________。
22.可逆反应:aA(气)+bB(气) ![]() cC(气)+dD(气);△H=Q试根据图回答:
cC(气)+dD(气);△H=Q试根据图回答:

(1)压强P1比P2______(填大、小),
(2)体积(a+b)比(c+d)______(填大、小),
(3)温度t1℃比t2℃______(填高、低),
(4)Q值是______(填正、负)。
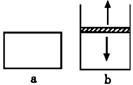 23.已知2NO2
23.已知2NO2![]() N2O4+Q。将NO2充入容易导热的材料制成的容器a和b中进行反应。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。
N2O4+Q。将NO2充入容易导热的材料制成的容器a和b中进行反应。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。
当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始。
(1)反应开始时,a与b中生成N2O4的速率va______vb。
(2)反应过程中两容器里生成N2O4的速率是va______vb。
(3)达到平衡时,a与b中NO2转化为N2O4的百分数(A)相比较,则是Aa______Ab。
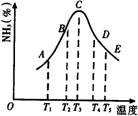 24.在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2
24.在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是_______。
(2)此可逆反应的正反应是______反应。(放热、吸热)
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由。____________________________________
五、计算题
25.在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
26.在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)![]() 3Z(气),已知加入1 molX和3molY,达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3molY,达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
化学反应速率化学平衡参考答案
1.C 2.B 3.A 4.C 5.C 6.D 7.B 8.D 9.D 10.AD 11.CD 12.D 13.AB 14.A 15CD 16.B 17.C 18.BC
19. (1)B;
(2)将该装置浸入冰水中,颜色变浅,再取出,擦干水,放在酒精灯上烘烤,颜色变深。
(3)稀氨水和酚酞的混合溶液;被SO2漂白后的品红溶液(提示:①气体和液体都处在同一个封闭体系中,受热时气体在水中溶解度减小而从水中逸出,冷却后气体又溶于水,回复到加热前的状态。②氨水的平衡;NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,受热时平衡向左移动,逸出NH3气,溶液中[OH-]降到一定值时酚酞不显色,溶液褪为无色。被SO2漂白了的品红溶液在受热时SO2从水中逸出,品红恢复红色,冷却后SO2溶于水又将品红漂白。)
NH4++OH-,受热时平衡向左移动,逸出NH3气,溶液中[OH-]降到一定值时酚酞不显色,溶液褪为无色。被SO2漂白了的品红溶液在受热时SO2从水中逸出,品红恢复红色,冷却后SO2溶于水又将品红漂白。)
20. (1)A (2)2A=B+3C (3)0.4mol/(L·min)
21. ①往溶液中加水稀释 ②往溶液中加入硝酸银溶液
22. (1)小 (2)小 (3)高 (4)正
23. (1) = ; (2) < ; (3) <
24.(1)A、B (2)放热 (3)AC:反应开始v正>v逆,反应向右进行生成NH3。CE:已达平衡,升温使平衡左移,NH3%变小
25. N2 22% , H2 66%
26. (1)2 a mol (2)6 (3)1.9, 1.2