高考理综化学试题
7.NA 代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为5 NA
B.1molMgCl2 中含有离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2 NA
D.1 mol C10H22 分子中共价键总数为31 NA
8.核磁共振(NMR)技术级广泛应用于复杂分子结构的测定和医学论断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.![]() B.
B. ![]()
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
9.仅用一种试剂鉴别如下物质:CCl4、NaI溶液、NaCl溶液、Na2SO3 溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3 溶液 C.酸性KMnO4 溶液 D.AgNO3 溶液
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH―)>c(H+)
B.10mL01mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH―)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH―)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合: c(Cl-)>c(Na+)>c(OH―)>c(H+)
11.在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
![]()
12.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
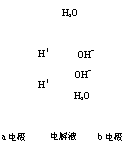
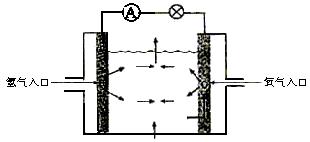
A.a电极是负极
B.b电极的电极反应为:4OH―-4e―=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
13.一定条件下,向一带活塞的密闭容器中充入2mol SO2 和1mol O2
,发生下列反应: 2SO2(g)+O2![]() 2SO3(g)达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1molSO2(g)
B.保持温度和容器压强不变,充入1molSO3(g)
C.保持温度和容器压强不变,充入1molO2(g)
D.保持温度和容器压强不变,充入1molAr(g)
26.(14分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱,但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
⑴单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。⑵写出锌和氢氧化钠溶液反应的化学方程式 。
⑶下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
⑷写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
27.(19分)烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如:
|
|
|
|
I.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧热为1789kJ/mol,试写出丙醛燃烧的热化学方程式 。
II.上述反应可用来推断烯烃的结构,一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C,化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
|
|
|
|
|
|
|
|
回答下列问题:
⑴B的相对分子质量是 ;D→F的反应类型为 。D含有官能团的名称 。
⑵D+F→G的化学方程式是 。
⑶A的结构简式为 。
⑷化合物A的某种同分异构体通过臭氧氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有 种。
28.(19分)I.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途 。II.实验室制备,下列方法中适宜选用的是 。
①固态氯化铵加热分解 ②固体氢氧化钠中添加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④固态氯化铵与氢氧化钙混合加热
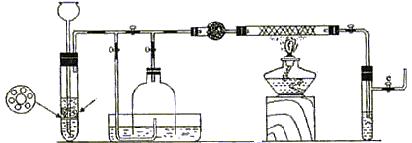
III.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a 、b、c、d、e,在A中加入锌粒,向长颈漏斗注入一定量稀硫酸,打开弹簧夹c、d、e,则A中有氢气发生,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
⑴检验氢气纯度的目的是 。
⑵C瓶内水位下降到液面保持不变时,A装置内发生的现象是 。防止了实验装置中压强过大,此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
⑶在步骤③中,先加热铁触媒的原因是 ,反应管E中发生反应的化学方程式是 。
![]() 29.(14分)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
29.(14分)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
⑴NO的体积为 L,NO2 的体积为 L。
⑵待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol/L
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水
g。
参考答案
7.D 8.C 9.D 10.B 11.A 12.B 13.B
26.(14分)⑴AlO2―[ 或Al(OH)4-] ⑵Zn+2NaOH![]() Na2ZnO2+H2↑[或,zn>+2NaOH+2H2O
Na2ZnO2+H2↑[或,zn>+2NaOH+2H2O![]() Na2Zn(OH)4+H2↑] ⑶①③④ ⑷Al3++3NH3•H2O=Al(OH)3↓+3NH4+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量的氨水中,生成Zn(NH3)42+,氨水的用量不易控制
Na2Zn(OH)4+H2↑] ⑶①③④ ⑷Al3++3NH3•H2O=Al(OH)3↓+3NH4+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量的氨水中,生成Zn(NH3)42+,氨水的用量不易控制
|
|
29.(14)⑴5.8 5.4 ⑵(aV·10-3+0.5)/0.14 ⑶57.8