高考能力测试步步高化学基础训练1
物质的组成、分类及相互关系
(时间60分钟,赋分100分)
●训练指要
本训练点主要要求:掌握分子、原子、离子、原子团、元素、混合物、纯净物、单质、化合物、金属、非金属等重要概念;理解酸、碱、盐、氧化物的概念及其相互转化关系。
一、选择题(每小题5分,共50分)
1.(2002年上海高考题)已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有
A.3种 B.6种 C.9种 D.12种
2.(2002年上海高考题)水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
 |
3.(2002年上海高考题)C60与现代足球 球 有很相似的结构,它与石墨互为
A.同位素 B.同素异形体
C.同分异构体 D.同系物
4.(2002年全国高考题)碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是
A.I2O5 B.I2O4 C.I4O7 D.I4O9
5.(2002年全国高考题)将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3 mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)或c(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
6.下列说法正确的是
A.一个过氧化氢分子中含有两个氢原子和两个氧原子
B.在化合物中,元素的化合价的数值就是原子得失电子的数目,失去电子为正价,获得电子为负价
C.水分子是由两个氢元素和一个氧元素组成
D.能电离出H+和酸根离子的物质一定是酸
7.下列几组物质①冰和干冰 ②甘氨酸和硝基乙烷 ③水和重水 ④纯碱和烧碱 ⑤金刚石和石墨,其中组成元素不相同的是
A.①和③ B.②和④
C.②和⑤ D.①和④
8.下列物质属于混合物的一组是
①明矾 ②过磷酸钙 ③漂白粉 ④水煤气 ⑤玻璃 ⑥水晶 ⑦聚氯乙烯 ⑧汽油
A.①②③④⑤⑥ B.②③④⑤⑥⑧
C.②③④⑤⑦⑧ D.③④⑤⑥⑦⑧
9.下列化学式中,只表示一种纯净物的是
A.C2H4O2 ![]()
C.C D.CH2O2
10.乙炔、苯和乙醛的混合物中w(C)=72%(w为质量分数),则w(O)是
A.22% B.19.6% C.8.8% D.4.4%
二、非选择题(共50分)
11.(4分)现有某种不溶于水的金属氧化物,如要判别它是酸性氧化物、碱性氧化物还是两性氧化物,其方法是 。
12.(7分)保持氮气化学性质的最小粒子是 。水在发生化学变化时,
发生变化,但 不改变。在金刚石、铜、高锰酸钾、足球烯(C60)、硫酸中, 是由原子直接构成的, 是由分子构成的, 是由离子构成的, 是由金属阳离子和自由电子构成的。
13.(2分)锗酸![]() (简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗处于它的最高价态,
(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗处于它的最高价态,![]() 元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中
元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中![]() 具有8电子稳定结构。BGO的化学式为
。
具有8电子稳定结构。BGO的化学式为
。
14.(6分)A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系:
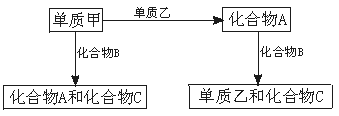
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 。(用A、B、C字母填写)
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的分子式可能是 ,则化合物B的分子式是 。
15.(6分)(2002年全国高考试题)如图所示:
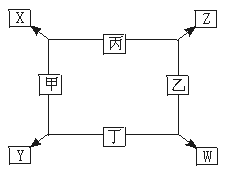
已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是 。
(2)甲与丙反应生成X的化学方程式是 。
(3)乙与丁反应生成W的化学方程式是 。
16.(10分)Cl2和NO2在室温下可以化合生成一种新的气态化合物C,为了测定C的分子组成,进行以下实验。取混合气体总体积5 L,测定反应后总体积随Cl2在混合气体中所占体积分数(x)的变化规律。实验测知当Cl2所占体积分数为20%或60%时,反应后的总体积均为4 L。
(1)通过分析和计算求得化合物C的化学式为 ,发生反应的化学方程式为 。
(2)试讨论当x的取值范围不同时,反应后总体积(V)随x变化的函数关系。
17.(6分)已知高温下能发生如下反应:Si+C===SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。
(1)写出可能发生反应的化学方程式。
(2)若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
| x值 | 残留固体分子式(或化学式) | 物质的量/mol |
说明:①残留固体物质的量用a,x等表示,不必列出具体的计算式。
②每组空格填一种情况,有几种填几种,不必填满。
18.(9分)钇(Y)元素可用于制造激光发生器和超导材料,我国蕴藏丰富的含钇矿石(YxFeBe2Si2O10),矿石中铁为+2价。现将4.68 g钇矿石样品与氢氧化钠共熔,反应后加适量水溶解过滤,滤渣中有Y(OH)3和Fe2O3,滤液中有Na2SiO3和Na2BeO2等,此反应中钇元素的化合价未变化。将滤液配成1 L溶液,测其pH=13,往此溶液中加入100 mL 3.3 mol/L的盐酸后,溶液pH=1,其中有BeCl2等物质。(假设反应前后溶液体积无变化)
(1)根据反应中铍元素的变化,分析Be(OH)2属于何种性质的氢氧化物。
(2)推算x的值。
(3)计算钇元素的相对原子质量。
高考能力测试步步高化学基础训练1答案
一、1.C 2.C 3.B
4.解析:碘酸根即为IO![]() ,其碘显+5价,则碘酸碘应为:
,其碘显+5价,则碘酸碘应为:![]() (
(![]() O3)3,可表示为I4O9。
O3)3,可表示为I4O9。
答案:D
5.D 6.A 7.D 8.C 9.D
10.解析:C2H2、C6H6、CH3CHO[C2H2(H2O)]取100 g混合物:C为72 g,H2O为
100 g-72 g-6 g=22 g。
w(O)=22
g×![]() =19.6 g
=19.6 g
答案:B
二、11.溶于酸的是碱性氧化物,溶于碱的是酸性氧化物,既能溶于酸,又能溶于碱的是两性氧化物
12.氮分子 分子 原子 金刚石 足球烯和硫酸 高锰酸钾 铜
13.Bi4(GeO4)3或Bi4Ge3O12
14.(1)AB
(2)非金属 因为A+B![]() 乙+C,且乙为单质,可知乙元素在A、B中分别呈正、负价,所以乙是非金属
乙+C,且乙为单质,可知乙元素在A、B中分别呈正、负价,所以乙是非金属
(3)S H2S(或:H2 NH3)
15.(1)N2 O2
(2)N2+3Mg![]() Mg3N2
Mg3N2
(3)O2+2H2![]() 2H2O
2H2O
或答:(2)N2+3H2![]() 2NH3
2NH3
(3)O2+2Mg===2MgO
16.(1)NClO2 Cl2+2NO2===2NClO2
(2)当0<x≤![]() 时V=5-5x;当
时V=5-5x;当![]() <x<1时,V=5-
<x<1时,V=5-![]() (1-x)
(1-x)
17.(1)SiO2+2C===Si+2CO SiO2+3C===SiC+2CO
(2)
| x值 | 残留固体分子式(或化学式) | 物质的量/mol |
| x>1/3 | SiO2、Si | a/2(3x-1)、a/2(1-x) |
| x=1/3 | Si | a/3 |
| 1/4<x<1/3 | Si、SiC | (4x-1)a、(1-3x)a |
| x=1/4 | SiC | a/4 |
| x<1/4 | C、SiC | (1-4x)a、ax |
18.(1)铍元素在强碱过量时,以BeO![]() 形式存在;在强酸过量时,以Be2+形式存在,所以,Be(OH)2为两性氢氧化物(2)x=2(3)89
形式存在;在强酸过量时,以Be2+形式存在,所以,Be(OH)2为两性氢氧化物(2)x=2(3)89