高考能力测试步步高化学基础训练2
氧化还原反应及配平
(时间60分钟,赋分100分)
●训练指要
本训练点是历年高考的热点之一。考查的主要内容有:氧化还原反应的几组基本概念;判断氧化还原反应中电子转移的方向和数目;配平反应方程式。其中物质的氧化性、还原性强弱比较是本知识点的重点。
一、选择题(每小题5分,共50分)
1.(2002年全国高考题)R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z===X+Z2+;Y+Z2+===Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+
B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+
D.Z2+>X2+>R2+>Y2+
2.在一定温度下,NH4NO3分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O在此反应中被氧化和被还原的氮原子数之比是
2HNO3+4N2+9H2O在此反应中被氧化和被还原的氮原子数之比是
A.5∶3 B.5∶4 C.1∶1 D.3∶5
3.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl。ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:
2ICl+2Zn===ZnCl2+ZnI2
ICl+H2O===HCl+HIO
下列叙述中正确的是
A.ZnCl2既是氧化产物,又是还原产物
B.ICl跟H2O的反应是自身氧化还原反应
C.ZnI2既是氧化产物,又是还原产物
D.在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂
4.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出。下列说法中正确的是
A.都属于氧化还原反应
B.CaC2、Mg3N2与水反应属于复分解反应
C.Na2O2、CaH2与水反应时水作氧化剂
D.CaH2与水反应时产生H2,它是氧化产物和还原产物
5.已知A2O![]() 可与B2-反应,B2-被氧化,产物为B单质,A2O
可与B2-反应,B2-被氧化,产物为B单质,A2O![]() 被还原,产物为A3+,且知100
mL c(A2O
被还原,产物为A3+,且知100
mL c(A2O![]() )=0.3 mol·L-1的溶液与150
mL c(B2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为
)=0.3 mol·L-1的溶液与150
mL c(B2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为
A.4 B.5 C.6 D.7
6.某单质能与足量浓硝酸反应放出NO2气体,若参加反应的单质和硝酸物质的量之比为1∶a,则该元素在反应中所显示的化合价是
A.+2a B.+a C.+![]() D.+
D.+![]()
7.G、Q、X、Y、Z均为氯的含氧化合物。不了解它们的化学式,但知道它们在一定条件下具有如下的转移关系(未配平):
①G![]() Q+NaCl
Q+NaCl
②Q+H2O![]() X+H2
X+H2
③Y+NaOH![]() G+Q+H2O
G+Q+H2O
④Z+NaOH![]() Q+X+H2O
Q+X+H2O
则这些化合物中氯的化合价由高到低的排列顺序,正确的是
A.XZYQG B.XZQYG
C.ZXQYG D.QYGXZ
根据下表提供的材料,回答8、9题。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
8.若对应于上述离子方程式的电子转移总数为10,则反应物、生成物的组序号是
A.②和④ B.只有② C.只有④ D.只有③
9.下列叙述中,正确的是
A.表中第①组反应的氧化产物只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数应为16
10.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O ⑥Cl2和H2O ⑦NO2和H2O
A.③④⑤⑥⑦ B.①⑤⑦
C.②③⑤ D.③⑥⑦
二、非选择题(共50分)
11.(8分)(2002年全国高考题)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
12.(8分)在热的稀硫酸溶液中溶解了11.4 g FeSO4,当加入50 mL 0.5 mol·L-1 KNO3溶液后,使其中的Fe2+全部氧化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
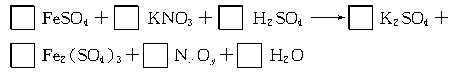
(1)推算出x= ,y= 。
(2)配平上述化学方程式,标出电子转移的方向和数目。
(3)反应中的氧化剂是 。
13.(8分)长期以来,一直认为氟的含氧酸不存在,1971年用F2通过细冰末获得次氟酸(HFO)以来,对HFO的研究引起了充分的重视。
(1)HFO能与水反应得溶液A,A中含B、C两种溶质,B常用于雕刻玻璃,C为氧的质量分数最高的氧化物。F2与细冰反应的化学方程式: ,C的化学式为 。
(2)将A滴入紫红色酸性KMnO4溶液中,溶液紫红色褪去,完成并配平下列离子方程式:
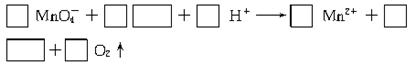
当有NA个电子发生转移时,被氧化的C为 mol。
14.(10分)有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z。X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比为1∶1组成的化合物,其他元素形成单质(仍用a、b、c表示)和组成的化合物间反应关系式如下(未配平):
①b+c![]() Y ②a+c
Y ②a+c![]() Z
Z
③X+Y![]() m ④X+Z
m ④X+Z![]() c+n
c+n
⑤Y+Z![]() c+n
c+n
回答下列各题:
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是 ,其充分理由是 。
(2)如果m是一种无色、粘稠的油状液体化合物,则X、Y、Z分别是 ;写出下列反应方程式③ ;④ 。
15.(10分)(2001年春季高考题)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的氮氧化物(如NO2),当加热至一定温度时,它发生如下分解:C3N3(OH)3===3HNCO。HNCO(异氰酸,其结构是H—N==C—O)能和NO2反应生成N2、CO2和H2O。
(1)写出HNCO和NO2反应的化学方程式,分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.0 kg NO2气体消耗的三聚氰酸的质量。
16.(6分)化合物BrFx与水按物质的量之比为3∶5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1)BrFx中,x=
(2)该反应的化学方程式是 。
(3)此反应中的氧化剂和还原剂各是什么?
高考能力测试步步高化学基础训练2答案
一、1.A
2.解析:5 mol NO![]() 中有2 mol NO
中有2 mol NO![]() 没有被还原。
没有被还原。
答案:A
3.解析:ICl中I的化合价为+1,Cl的化合价为-1。
答案:C
4.BD 5.D 6.BC 7.B 8.A 9.D 10.D
二、11.(1)2MnSO4+5K2S2O8+8H2O![]() 2KMnO4+4K2SO4+8H2SO4
2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4
(3)2Mn2++5S2O![]() +8H2O
+8H2O![]() 2MnO
2MnO![]() +10SO
+10SO![]() +16H+
+16H+
(4)Cl2
12.(1)x=y=1
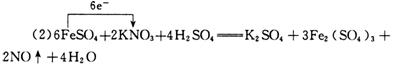
(3)KNO3
13.(1)F2+H2O===HFO+HF H2O2
(2)2MnO![]() +5H2O2+6H+===2Mn2++8H2O+5O2↑
0.5
+5H2O2+6H+===2Mn2++8H2O+5O2↑
0.5
14.(1)①②④⑤ 这些反应中有单质生成或单质参加反应
(2)H2O2、SO2、H2S
③H2O2+SO2===H2SO4
④H2O2+H2S===S↓+2H2O
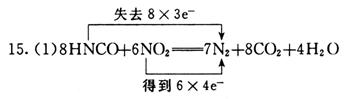
HNCO中的氮元素被氧化,NO2中的氮元素被还原。
(2)1.0
kg×![]() =1.2 kg
=1.2 kg
16.(1)3
(2)2BrF3+5H2O===HBrO3+9HF+Br2+O2↑
(3)BrF3为氧化剂;还原剂为H2O、BrF3。