高三第一学期第一次质量检测化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1至4页,第Ⅱ卷5至8页。共150分。考试时间120分钟。
本试卷可能用到的相对原子质量:H: 1 O:16 S:32 Na: 23
N:14 Al:27
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A、该粒子不显电性; B、该粒子质量数为4;
C、在周期表中与氢元素占同一位置; D、该粒子质量比氢原子大
2.美国(科学)杂志报道,在40GPa高压下,用激光加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是:
A、原子晶体干冰有很高的熔、沸点,有很大的硬度;
B、原子晶体干冰易气化,可用作制冷材料;
C、原子晶体干冰硬度小,可用作润滑材料;
D、每摩尔原子晶体干冰中含2 mol C—O键;
3.化学研究中,只有了解物质的结构,才能深刻地认识它们的性质和变化规律。下列关于物质结构的说法正确的是
A、冰是由氢原子和氧原子直接构成的
B、失电子难的原子获得电子的能力不一定强
C、原子及其离子的核外电子层数等于该元素所在的周期数
D、M层电子为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等
4.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
5.下列四图中,白球代表氢原子、黑球代表氦原子。表示等质量的氢气与氦气混合气体的是
A.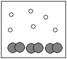 B.
B. C.
C. D.
D.
6.下列实验能达到测量要求的是
A. 用托盘天平称取35.20g NaCl B. 用10ml量筒量取8.50ml盐酸
C. 用25ml滴定管量取15.80ml溶液 D. 用PH试纸测得溶液PH值为4.2
7.比较合成氨工业与接触法制硫酸中SO2催化氧化的生产过程,下列说法错误的是
A.都使用了合适的催化剂
B.都选择了较高的温度
C.都采用了使其中一种原料过量以提高另一种原料利用率的方法
D.都考虑了经济效益,选用了适宜的压强条件
8.下列有关实验所选用的试剂能达到目的是
A.证明NaHCO3溶液中混有苏打用澄清石灰水
B.用食盐、MnO2和浓H2SO4共热制Cl2
C.足量Cl2通入FeCl2 溶液后,将溶液蒸干得到FeCl3
D.将Cu丝伸入热的硫蒸气中得到CuS
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列说法中不正确的是
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数。
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
10.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是:①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④ C.只有②③④ D.有①②③④
11.目前科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述不正确的是
A、该反应为置换反应 B、该晶体为分子晶体
C、该物质是一种新化合物 D、该物质的相对分子质量为2400
晶体可以分为分子晶体、离子晶体、原子晶体等,在以下两个题目中,分别对不同晶体的组成、微粒间的作用力以及晶体的几何构型等进行了描述,请根据各题的提问做出选择:
12.下列关于只含非金属元素的化合物的说法正确的是
A 一定是共价化合物,且只能构成分子晶体;
B 其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
C 其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
D 可能是离子化合物。
13.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为
A 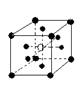 B
B 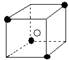 C
C 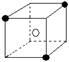 D
D 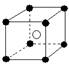
14.某混合气体可能含有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),则可断定该混合气一定有
A.HCl、CO、H2O B.CO、H2、H2O
C.CO、H2、NH3 D. HCl、CO2、H2
15.不用其它试剂(可以加热),就能将下列溶液一一鉴别开来的是
A.NaOH、NaHCO3、NaHSO4、AlCl3 B.Ba(CH3COO)2、NaNO3、Ba(OH)2、H2SO4
C.NaOH、NH4NO3、HCl、KNO3 D.Na2SO4、Ca(NO3)2、BaCl2、Na2CO3
16.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下NO2和N2O4的混合气体,分子总数为NA
B.1mol羟基(-OH)中所含电子数为10NA
C.在用SiO2制取Si的反应中,每生成1molSi,转移电子数是4NA
D.在含1molH2O的冰中,存在的氢键的数目为2mol
17.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
A.X2+具有还原性 B.X的+2价化合物比+4价化合物稳定
C.XO2具有强氧化性 D.该元素是第ⅡA族元素
18.化工厂厂址的选择是一个复杂的问题,涉及原料、水源、能源土地供应、市场需求、交通运输和环境保护等诸多因素。硫酸厂应建在:
①靠近原料产地、远离消费中心;②靠近消费中心、稍偏离原料产地;③交通便利,人口稠密的居民区;④环保要求高的地区,便于“三废”治理;⑤风景秀丽、水资源充足的旅游胜地。
A.①②③④⑤ B.只有③④ C.只有② D.①②⑤
第Ⅰ卷 (选择题 共72分)答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | ||||||||||
第Ⅱ卷(非选择题 共78分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接写在试题卷上。
2.答卷前将密封线内的项目填写清楚。
三、(本题包括2小题,共26分)
19.(10分) 实验室用氯化钙固体和其他有关试剂(因为硝酸银价格昂贵不能使用),制取一定量纯净的硝酸钙固体
① 写出表示制取过程中反应原理的化学方程式
② 简述实验操作步骤(不要求回答使用的仪器,但要求回答试剂的用量:少量、适量或过量)
A. ;
B. ;
C. ;
D. 。
20.(16分) 化学工业在江苏国民经济中占有极其重要的地位,我省是国内最早的硫酸生产基地之一。工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的流程设计出来的。见下图:
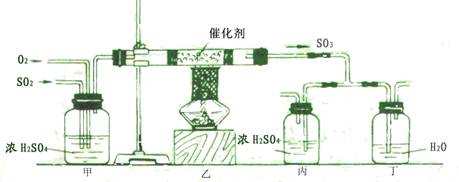
(1)写出二硫化亚铁与氧气反应的方程式: ;
(2)请写出上图甲装置的作用 ① ② ③ ;
(3)写出在催化剂表面所发生的反应的方程式: ;
(4)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制与估计的?
;
(5)学生为了比较探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而不用水,特用上述装置进行模拟实验。若丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直都没有任何现象,产生这种现象的原因是:
;
(6)处理尾气的方法有: 。
 四、(本题包括2小题,共18分)
四、(本题包括2小题,共18分)
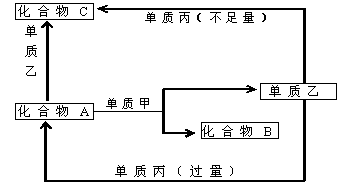
21.(10分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是___ __;B的电子式是__ ___,
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中,只有甲由短周期元素组成。乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中、通常条件下进行,则:
①A与乙反应的离子方程式为:_____ ;
②C与丙反应的离子方程式为:_____ ____;
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为:____ _____。
22.(8分)1971年,斯图杰尔和阿佩里曼成功地合成了次氟酸。他们是在0℃以下将氟从细冰末上通过,得到毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,分子中原子间也以共价键结合。
⑴写出次氟酸的结构式 ;
⑵写出上述制取次氟酸的化学方程式 ;
⑶次氟酸很不稳定,试预测其受热分解的可能途径,用化学方程式表示:
;
⑷次氟酸在刹那间能完成与热水的反应,此时得到的溶液,既表现有氧化性(对于Iˉ),又表现有还原性(对于MnO4ˉ),可推测次氟酸与热水反应的产物中含有 。
 五、(本题包括2小题,共16分)
五、(本题包括2小题,共16分)
23.(8分)从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。右图是立方体形状的NaCl离子团簇,其中大球代表Cl—,小球表代Na+。请回答下列问题:
① 与等质量的NaCl离子晶体相比,NaCl离子团簇具有 (填“较多”或“较少”)的悬挂键:
② NaCl离子团簇的熔点比NaCl大块晶体的熔点要 (填“高”、“低”或“—样”);
③ 如果团簇中离子对数相同,则团簇的总能量与团簇的外形是否有关 。
④ 食盐晶体由钠离子和氯离子组成,这两种离子在空间的三个垂直方向都是等距离地交错排列。已知食盐的密度是2.2g/cm3,则食盐中相邻的钠离子核间的数值最接近于( )
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
24.(8分)已知氯化铝晶体的熔点为190℃(2atm),但它在180℃即开始升华。
①氯化铝是 (填“离子化合物”或“共价化合物”),是 晶体
②在500℃和1atm时,它的蒸气密度为11.92g/L(已折算成标况),且已知它的结构中有特殊的化学键存在,氯化铝的化学式为 。
③设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物,你设计的实验是:
。
六、(本题包括2小题,共18分)
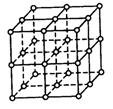 25.(1)纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
25.(1)纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
(2)假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的2倍,试估算表面原子占总原子数的百分比。
26.某同学称取5.4g金属铝粉,用来制取Al(OH)3。现有如下的药品:150mL 1.0mol/L的NaOH溶液、150mL 0.5mol/L H2SO4溶液、100mL 2.0mol/L NaHCO3溶液。
(1)该同学最多可以制取Al(OH)3的物质的量为 ;
(2)实验中,该同学使用了10mL 0.5mol/L H2SO4溶液,则他所用的1.0mol/L NaOH溶液至少为 mL或2.0mol/L NaHCO3溶液 mL;
(3)如果制得的Al(OH)3为a mol, 则需要0.5mol/L H2SO4溶液的体积(V)的取值范围应为: (用a的表达式表示)。
第一学期高三质量检测化学答案
第Ⅰ卷(选择题 共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | C | A | B | D | B | C | C | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | A | A | D | B | D | AB | CD | D | C |
第Ⅱ卷(非选择题 共78分)
19. ①CaCl2+Na2CO3=CaCO3↓+2NaCl (1分)
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑ (1分)
②A.用蒸馏水完全溶解CaCl2后,加入足量Na2CO3溶液。 (2分×4)
B.将反应后的溶液过滤,并用蒸馏水洗涤沉淀至无Cl-。
C.加入足量HNO3,使沉淀完全溶解。
D.将溶解后的溶液蒸发、结晶。
20.(1)4FeS2 + 11O2 =煅烧= 2Fe2O3 + 8SO2 (2分×8)
(2)控制气流、混合气体、干燥
(3)SO2 + O2 = 2SO3
(4)可以通过调节气阀,控制气体流量,观察甲装置的冒泡速率估计。
(5)原因有两个:(1)浓硫酸对三氧化硫的吸收效果远好于水,三氧化硫被浓硫酸完全吸收了;(2)插入浓硫酸溶液的导管插得太深,导致两个吸收瓶内的气压差较大,三氧化硫气体往水中冒出来了,与水蒸气化合形成酸雾。
(6)用碱液吸收。
21.(1) O=C=O、 ![]() (2分×5)
(2分×5)
(2)① Br2 +2Fe2+ = 2Br- + 2Fe3+
② 2Fe3+ + Fe = 3Fe 2+
③ 2Fe2+ +4Br- +3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
22.H-O-F,F2 + H20==HF + HOF,2HOF ==2HF + O2,H2O2 (2分×4)
23.①较多 ② 低 ③ 有关 ④ C (2分×4)
24.①共价化合物、分子晶体 (2分×4)
② Al2Cl6
③熔融AlCl3晶体测导电性,如熔融液不能导电,则说明为共价化合物。
25.① 96.3% ②78.4% (3分×2)
26.(1)0.2mol (2) 10、5 (3)3a/4 < V <3a (3分×4)