分子和晶体
该题型包括判断分子的极性,判断晶体类型和物质的性质,解释物质的物理性质与分子间作用力的关系,解释物质的性质与晶体结构的关系,以及有关晶体结构的计算。前二者大多以小题目出现,后者则以大题目出现,其难度较大。
分 子
1.下列各组分子中,都属于含极性键的非极性分子的是 ( B )
A. CO2 H2S B. C2H4 CH4 C. Cl2 C2H2 D. NH3 HCl(96上海)
2.下列氢化物在液态时,分子间不存在氢键的是 ( D )
A.HF B.H2O C.NH3 D.CH4(01江西)
3.下列分子中,属于含有极性键的非极性分子的是 ( D )
A. H2O B. Cl2 C. NH3 D. CCl4(92MCE)
4.下列叙述正确的是 ( BC )
A. 同主族金属的原子半径越大熔点越高 (98MCE)
B. 稀有气体原子序数越大沸点越高
C. 分子间作用力越弱分子晶体的熔点越低
D. 同周期元素的原子半径越小越易失去电子
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类 1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳五个CH4分子或1个游离H2O分子。根据上述信息,完成第8、9题:
5.下列关于天然气水合物中两种分子极性的描述正确的是 ( D )
A. 两种都是极性分子 B. 两种都是非极性分子(01上海)
C. CH4是极性分子,H2O是非极性分子 D. H2O是极性分子,CH4是非极性分子
6.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为 ( B )
A. CH4·14H2O
B. CH4·8H2O C. CH4·![]() H2O D. CH4·6H2O(01上海)
H2O D. CH4·6H2O(01上海)
7.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是 ( C )
A.食盐和蔗糖熔化 B.钠和硫熔化(00MCE)
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
8.下列各组物质气化或熔化时,所克服的微粒间的作用(力)属于同类型的是( A )
A. 碘和干冰的升华 B. 二氧化硅和生石灰的熔化
C. 氧化钡和金属铁的熔化 D. 食盐和冰的熔化(广东90.22)
9.F2和Br2的沸点(MCE95.2) ( B )
A. 大于 B. 小于 C. 等于 D. 不能确定
晶 体
1.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( C )
A. 水由液态变为玻璃态,体积缩小 B. 水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态 D. 玻璃态水是分子晶体(02上海)
2.在下列有关晶体的叙述中错误的是 ( C )
A. 离子晶体中,一定存在离子键 B. 原子晶体中,只存在共价键(02上海)
C. 金属晶体的熔沸点均很高 D. 稀有气体的原子能形成分子晶体
3.关于晶体的下列说法正确的是 ( A )
A. 在晶体中只要有阴离子就一定有阳离子(99广东、MCE)
B. 在晶体中只要有阳离子就一定有阴离子
C. 原子晶体的熔点一定比金属晶体的高
D. 分子晶体的熔点一定比金属晶体的高
4.下列晶体中,不属于原子晶体的是 ( A )
A. 干冰 B. 水晶 C. 晶体硅 D. 金刚石(92MCE)
5.下列含有极性键的离子晶体是 ( B )
A. CH3COOH B. NaOH C. Na2O2 D. MgCl2 (97上海)
6.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( B )
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl(93MCE)
7.下列物质属于原子晶体的化合物是 ( C )
A. 金刚石 B. 刚玉 C. 二氧化碳 C. 干冰(00上海)
8.下列物质属于分子晶体的化合物是 ( C )
A. 石英 B. 硫磺 C. 干冰 D. 食盐(01上海)
9.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下: (98上海)
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的核外电子排布式
(2) b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示)
(3) d溶于水的电离方程式
(4) g粒子所构成的晶体类型属
(5) c粒子是 ,f粒子是 (用化学式表示)
(1)1s22S22p6 (2)NaOH>Mg(OH)2 `(3) NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH- (4)分子晶体
+OH- (4)分子晶体
10.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 (93.4) ( B )
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl
11.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是 ( A )
A. ①③② B. ②③① C. ③①② D. ②①③(MCE91.2)
12.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出氢气。下列叙述中,正确的是(MCE91.22) ( BC )
A. NaH在水中显酸性
B. NaH中氢离子的电子层排布与氦原子相同
C. NaH中氢离子半径比锂离子半径大
D. NaH中氢离子可被还原成氢气
13.在金刚石的网状结构中, 含有由共价键形成的碳原子环, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________(填角度)。
6 109°28'或109.5° (MCE92.32)
14.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( A )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体(01广东河南)
15. (1) 中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)(99MCE)
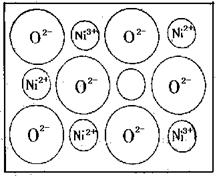
(2) 天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被Ni3+两个所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
33. (1) 1 cm3中阴、阳离子总数=(![]() )3
)3
1 cm3中Ni2+—O2-离子对数=(![]() )3×
)3×![]()
密度=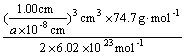 =
=![]() g·cm-3
g·cm-3
(说明:列式不化简不扣分;式中6.02×1023 mol-1用NA代入,即:
密度=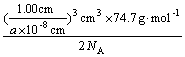 同样给分)
同样给分)
(2) 设1 mol中含Ni3+x mol,Ni2+ (0.97-x)mol
根据电中性:3x mol+2(0.97-x)mol=2×1 mol
x=0.06
Ni2+ 为(0.97-x)mol=0.91 mol
离子数之比Ni3+∶Ni2+=0.06∶0.91=6∶91
另解:(1) 因为在NiO晶体中,任意一个“离子”平均占有空间:( a×10-8)3cm3=a×10-24 cm3。
而一个“离子”平均具有的质量为:![]() =6.20×10-23
g
=6.20×10-23
g
所以,一个“离子”的密度(即晶体之密度)为:![]() =
=![]() g·cm-3
g·cm-3
(2) 比例法
因为Ni3+与Ni2+分别与O2-形成Ni2O3和NiO,所以每当有一个Ni3+存在时,就有x个Ni2+同时存在。
则由题意可得镍离子与氧离子数之比为:![]() =
=![]()
解之,得x=15.2。
所以,晶体中Ni3+与Ni2+的离子数之比为:1∶15.2=6∶91。
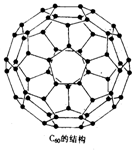
16.1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
(1) C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;(97MCE)
(2) C60分子只含有五边形;
|
|
(3) 多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数+面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1) 固体C60与金刚石相比较,熔点较高者应是_________,理由是:_____________________________________________
________________________________。
(2) 试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
___________,并简述其理由:__________________________________________。
(3) 通过计算,确定C60分子所含单键数。
(4) C70分子也制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。
36.(1) 金刚石
金刚石属原子晶体,而固体C60不是,故金刚石熔点较高。(答出“金刚石属原子晶体”即给分) (2)
可能 因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60 (只要指出“C60含30个双键”即给分,但答“因C60含有双键”不给分)
(3) 通过计算,确定C60分子所含单质数。依题意,C60分子形成的化学键为:![]() =90,也可以由欧拉定律计算键数(即棱边数):60+(12+20)-2 = 90,C60分子所含单键数为:C60分子中单键为:90-30=60。(答“2×30(双键数)=60”即给2分) (4) 设C70分子中五边形数为x,六边形为y。依题意可得方程组:
=90,也可以由欧拉定律计算键数(即棱边数):60+(12+20)-2 = 90,C60分子所含单键数为:C60分子中单键为:90-30=60。(答“2×30(双键数)=60”即给2分) (4) 设C70分子中五边形数为x,六边形为y。依题意可得方程组:
![]()
![]() (键数,即棱边数)
(键数,即棱边数)
70+(x+y)-![]() (欧拉定理)
(欧拉定理)
C分子中所含五边形数为解得:五边形数x=12,六边形数为六边形数y=25。
非本题原解:由C60分子知,该分子由60个碳原子构成,即C60分子结构中顶点数为60;又知每个碳原子与相邻三个碳原子形成价键,按有机化学相关知识,每个碳原子必须满足4个价键的规律,因此在每个碳原子形成的三个价键中,必须有一个为双键,有两个为单键,这样对C60分子来说,相当于单键数为双健数的两倍。
(1) 计算价键数(即棱边数)
由于每个碳原子连接三个价键(即棱边),对于C60分子来说,价键数(即棱边数)本应该为60×3=180个。但由于每一价键又被紧邻的两个五边形或六边形所共用,相当于有一半的价键(邻边)被重复计算。这样C60分子实际的价键数为60×3×![]() =90个。又由于90个价键中有
=90个。又由于90个价键中有![]() 的价键为双键,
的价键为双键,![]() 为单健,故分子中双键数为30个,单健数为60个。
为单健,故分子中双键数为30个,单健数为60个。
(2) 计算五边形及六边形的个数
根据欧拉定律,可列出顶点数、面数与棱边数三者的关系。再找出所有五边形及六边形的边数而列出方程。
设五边形有x个,六边形有y个,那么分子的总面数为x+y个,可得:
![]() 60+(x+y)-2=60×3×
60+(x+y)-2=60×3×![]() =90
=90
![]() =60×3×
=60×3×![]() =90
=90
解得x=12,y=20。