高考第一轮复习——氮族元素
第三节 硝酸
一、复习目标
1. 硝酸的性质:强氧化性,挥发性和不稳定性,强酸性
2. 硝酸的工业制备
3. 有关计算
二、基本知识
1. 硝酸化学性质:
①强酸性:稀硝酸+石蕊试液 先变红后褪色
![]()
![]() a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;
a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;
②不稳定性:注意 b.区别浓硝酸与浓盐酸呈黄色的不同原因;
c.硝酸挥发性和不稳定性的区别
HNO3![]() a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
金属硝酸盐+氮氧化合物*

b.常温下使Fe、Al钝化;
③强氧化性
c.与非金属(S、C、P等)反应
d.与其他还原性物质反应:H2S、FeS、SO2、Na2SO3、KI、HBr、HI
e.王水:V(浓HNO3)∶V(浓HCl)=1∶3
*金属与硝酸反应的一般规律:(硝酸既做氧化剂,又做酸)
![]() NO2(浓HNO3)
NO2(浓HNO3)
![]() 氢以后的金属+ HNO3 = 硝酸盐+
氢以后的金属+ HNO3 = 硝酸盐+
NO(稀HNO3)
![]() 硝酸
NO2(浓HNO3)
硝酸
NO2(浓HNO3)
NO(稀HNO3)
活泼金属(氢以前)+ HNO3 = 硝酸盐+ NH4 NO3(极稀HNO3)
H2(极稀HNO3)

稀硝酸与变价金属铁反应的情况(产物与量有关):
![]() 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O
n(Fe):n(HNO3)≥3:8时产物为Fe2+
n(Fe):n(HNO3)≤2:8时产物为
2:8<n(Fe):n(HNO3)<3:8时产物为Fe2+与Fe3+;
2.硝酸的工业制备:
原理:4NH3+5O2![]() 4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
尾气吸收:NO2和NO NO2+NO+2NaOH=2NaNO2+ H2O消除对大气的污染
当V(NO2)∶V(NO)≥1∶1时,尾气可全部被吸收;当NO过量时,应先补充适量的O2;
三、题型与变式
硝酸的性质
1.
计算
(1)电子守恒法确定还原产物
1.某单质跟浓硝酸反应时,每有0.25mol单质反应就消耗1molHNO3,则单质元素氧化
后的化合价可能是 ( )
A.+1 B.+2 C.+3 D.+4
2.某金属单质跟一定浓度的HNO3反应,假定只有单一还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是 ( )
A.NO2 B.NO C.N2O D.N2
(2)不活泼金属与HNO3、H2SO4混酸反应的分析与计算
1.在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92gCu粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol/L)是 ( )
A.0.15 B.0.225 C.0.35 D.0.45
2.在某稀溶液中含有1molKNO3和4mol H2SO4,向其中加入1.5mol Cu粉,充分反应后产生的气体在标准状况下的体积为 ( )
A.11.2L B.22.4L C.33.6L D.22.4L~33.6L之间
(3)Cu和浓HNO3反应的计算
1.38.4mgCu与适量浓HNO3反应,Cu全部作用后,共收集到22.4mL(标况)气体,反应消耗HNO3的物质的量可能是 ( )
A.1.0×10—3 mol B.1.6×10—3 mol C.2.2×10—3 mol D.2.4×10—3 mol
问:气体的平均摩尔质量为 g/mol?NO3—减少的物质的量为 mol?H+减少的物质的量为 mol?
2.0.03molCu完全溶于HNO3,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol,求混合气体的平均摩尔质量 ( )
A.30 B.46 C.50 D.66
3.25.6mgCu能恰好与含1.4×10—3 mol HNO3的浓硝酸完全反应,使生成的气体溶于水,最终得到的气体在标况下的体积为 L
4.将agCu投入一定浓度的硝酸溶液中,反应中消耗HNO3为bg,若a:b=8:21,则反应中起酸作用的HNO3质量为 ( )
A.b/2g B.2bg C.3a/4g D.3b/4g
(2004年高考天津卷29)
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
⑴NO的体积为5.8L,NO2的体积为5.4L。
⑵待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为(aV•10—3+0.5)/0.14mol/L。
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8g。
(4)Fe与稀HNO3反应的分析与计算
1.将8.4gFe溶于一定量稀硝酸中,完全反应后,n(Fe2+)=n(Fe3+),则稀硝酸中含HNO3( )
A.0.125mol B.0.25mol C.0.375mol D.0.5mol
2.铁在热的稀硝酸中反应,其主要还原产物为N2O,而在冷的稀硝酸中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+。请分析下图,回答有关问题:
(5)硝酸工业制备中的多步计算
1.氨氧化制硝酸时,如果由氨制成NO的产率96%,由NO制成硝酸的产率是93%。10t
氨可制备多少吨50%的硝酸?(答案:65.46吨)
2.如果化肥厂用NH3制NH4NO3,已知由氨制成NO的产率96%,由NO制成硝酸的产率是92%,利用反应NH3+HNO3=NH4NO3。则制HNO3所用去的NH3质量占总消耗NH3的质量分数为 53.1%
3.某化肥厂用NH3制HNO3再进一步制NH4NO3。已知:由NH3制HNO3的产率88%;
由NH3与HNO3反应制NH4NO3时的产率为98%;若用100tNH3制NH4NO3时,用于制
HNO3的氨为 53.2 t,可制出NH4NO3 215.9 t。
实验
1.用如下图所示的简易装置可以进行气体的发生和收集。
⑴实验前应如何检查装置的气密性?
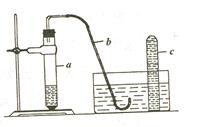 ⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速率缓慢,逐渐加快。请写出在试管a中发生的所有反应的化学方程式。
⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速率缓慢,逐渐加快。请写出在试管a中发生的所有反应的化学方程式。
2.
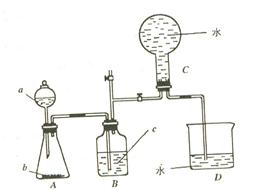 下图所示装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。请回答下列问题:
下图所示装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。请回答下列问题:
⑴气体X的化学式是
⑵所选药品a是 ,b是 ,装置B的作用是 。
⑶用所选药品发生反应生成X时,离子方程式是 。
⑷在反应刚开始时A中的主要现象是 。
3. 如图(图中有部分仪器未画出),有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连,烧瓶中有0.384gCu片,现向烧瓶中加入18mL2.5mol/L的稀硝酸溶液,并立即用锡箔包住的橡皮塞封住瓶口。
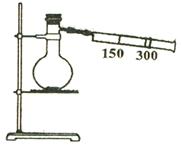 |
⑴欲提高Cu和稀HNO3的反应速率,可采取多种不同的措施:
①若采用加入化学试剂的方法,可加入
A.水 B.无水醋酸钠 C.铂丝 D.硝酸锌
②若用升高温度的方法,还需用到的仪器有
⑵橡皮塞用锡箔包住的原因是
⑶反应开始后,烧瓶中可观察到的现象主要有① ②
③ 。
⑷停止反应后,轻轻推拉注射器活塞,使气体与气体、气体与液体皆充分反应。若忽略液体体积的变化,最终溶液中NO3—的物质的量浓度与开始时相比
A.不变 B.变大 C.变小 D.无法确定
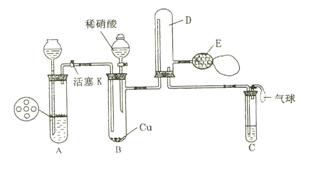
4. (2004天津一摸)为了验证铜与稀硝酸反应生成的气体为一氧化氮。某学生实验小组利用下图所示装置(加热及固定装置均已略去),设计了两个实验方案。其中E是用于鼓入空气的双连打气瓶。
方案一:A为H2的气体发生装置
![]() ⑴实验仪器连接完毕,关闭活塞K,如何检查 B C装置的气密性?
⑴实验仪器连接完毕,关闭活塞K,如何检查 B C装置的气密性?
⑵实验开始时,首先要在试管C处检查H2的纯度,其目的是:
⑶为验证铜与稀硝酸反应生成的气体为一氧化氮,反应一段时间后,由E向试管D中鼓入空气,可观察到的现象是 ,产生上述现象的原因是(用化学方程式表示) 。
⑷试管C中盛有的是NaOH溶液,作用是 。
方案二:A为CO2的气体发生装置
⑴装置A中发生反应的化学方程式为 。
⑵实验开始时,要使整个装置充满二氧化碳气体,图中需进行改进的装置是(填序号)若无其他任何可选仪器,你认为合理的改进措施是 。
⑶若试管C中盛有的是澄清石灰水,反应过程中在该溶液中观察到的现象是 。
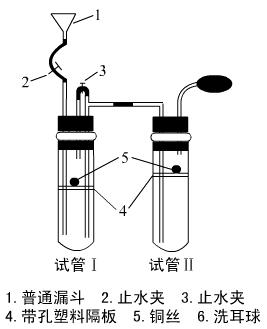
5.(2004第七次全国大联考)某教师用如图所示装置做有关“稀HNO3的氧化性及NO的性质”的课堂实验。其操作步骤如下:①检查装置的气密性;②在试管Ⅰ、Ⅱ的隔板上放置铜丝,撤去洗耳球,打开止水夹2、3,从1处漏斗加入稀硝酸,直至液面没及铜丝并与试管Ⅰ胶塞处相平;③关闭止水夹2、3,用酒精灯微热试管Ⅰ,当铜丝表面有气泡产生时,立即撤去酒精灯;④随着反应的进行,可以在试管Ⅰ上方观察到无色的NO,溶液渐显蓝色,生成的NO气体产生的压强促使硝酸沿着导管流入试管Ⅱ,当试管Ⅰ中的液面脱离铜丝时,反应停止;⑤稀硝酸流入试管Ⅱ,没及铜丝,微热试管Ⅱ,当铜丝表面有气泡产生时,立即撤去酒精灯;⑥当试管Ⅱ中有红棕色气体充满时,连接洗耳球,打开止水夹2;⑦实验结束后进行废气处理。试回答下列问题:
⑴检查装置气密性的方法及现象是 。
⑵步骤②中硝酸液面与试管Ⅰ胶塞处相平的目的是 。
⑶步骤③中发生反应的化学方程式为 。
⑷步骤⑥中红棕色气体产生的化学方程式为 ;连接洗耳球产生的结果是 ,其原因是 。