高考第一轮复习——氧族元素
第三节 硫酸
一、复习目标:
1. 掌握浓硫酸的性质
2. 了解硫酸根离子的检验方法
二、基本知识:
1. 硫酸的性质
(1) 物理性质
硫酸是具有不挥发性、高沸点的二元强酸。纯净的硫酸为无色、油状液体,密度比水大,可以任意比例溶于水,溶解过程中伴随着放热现象。(注意:稀释硫酸时应该如何操作?混合浓硫酸和浓硝酸是应该如何操作呢?)
(2) 化学性质:(“五性”)
① 不挥发性(用于制挥发性酸):
② 强酸性(制磷酸)
③ 吸水性(作干燥剂)
④ 脱水性
⑤ 强氧化性(钝化)
2. 硫酸根离子的检验
(1) 银离子的干扰
(2) SO32-、CO32-、PO43-的干扰
![]()
三、题型与变式:
| 硫酸的性质 |
1.将过量的金属投入到含0.200mol的热浓硫酸中,下列判断正确的是( )
A . 因发生“钝化”而不反应 B. 产生的SO2为0.100mol
C. 产生的SO2少于0.100mol D. 除SO2外还会有H2产生
2.将p%的浓硫酸与同体积的水混合,得到q%的稀硫酸,则的关系正确的是( )
A.p≤q B.p=2q C.p>2q D.p<2q
3. 用浓H2SO4吸收SO3可以得到H2SO4•SO3,若用1000g98%的H2SO4充分吸收SO3后,再进行稀释,可得到98%的硫酸的质量是多少千克?
4. 下列各叙述中说明硫酸具有什么性质,请填空:
⑴敞口放置于空气中的浓硫酸会增重; ⑵浓硫酸与食盐共热来制取氯化氢;
⑶用铁、铝金属容器可以运输浓硫酸; ⑷用浓硫酸和硝石反应制取HNO3;
⑸浓H2SO4与Cu反应制取SO2; ⑹新制的Cl2通过浓硫酸;
⑺浓H2SO4、浓HNO3与苯制取硝基苯; ⑻淀粉与稀硫酸溶液加热;
⑼浓硫酸与苯反应; ⑽浓硫酸与乙醇共热制取乙烯;
⑾浓硫酸滴在湿润紫色石蕊试纸后,观察到先变红后变黑的现象;
5.如图所示,小试管内盛有约3mL饱和硫酸铜溶液,与锥形瓶连通的U型管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢倒入约3mL浓硫酸,静置片刻。可观察所到的现象有(填标号,有多少个就填多少个) 。
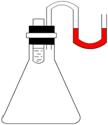 A.小试管内液体分成两层,上层蓝色,下层无色;
A.小试管内液体分成两层,上层蓝色,下层无色;
B.U型细管内左边液面下降,右边液面升高;
C.有少量白色固体析出;
D.以上现象都没有,无明显变化;
| 硫酸盐及硫酸根离子的检验 |
1.有一包固体混合物,由Ba(NO3)2、CaCO3、Na2S、CuSO4、BaCl2中若干种均匀混合而成,有关实验过程及记录如下:
(1)将粉末溶于水,得到蓝色溶液和白色沉淀,后将沉淀洗涤、烘干、称量质量为mg。
(2)向滤出的沉淀中加入盐酸,沉淀不溶解。
(3)把滤液分成三等份。第一份加稀硝酸和硝酸银溶液,无大量白色沉淀生成;第二份加入稀硫酸,无明显现象;第三份加入过量硝酸钡溶液,有白色沉淀生成,把沉淀滤出后洗涤、称量质量为mg。
试判断此白色沉淀的组成及它们的物质的量之比。
2.能够确定一种溶液中一定含有SO42—离子的事实是 ( )
A.取少量试液,加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
B.取少量试液,加入BaCl2溶液,有白色沉淀生成,再加稀HNO3,沉淀不消失;
C.取少量试液,加入Ba(NO3)2溶液,有白色沉淀生成;
D.取少量试液,加入Ba(NO3)2溶液,有白色沉淀生成,在过滤所得的沉淀中加盐酸,沉淀不溶解;
3.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42—。
方案甲:试液![]()
![]() 白色沉淀
白色沉淀![]() 沉淀不溶解;
沉淀不溶解;
方案乙:试液![]() 无沉淀
无沉淀![]() 白色沉淀;
白色沉淀;
方案丙:试液![]() 无沉淀
无沉淀![]()
![]() 白色沉淀
白色沉淀
试评价上述各方案是否严密,并分别说明理由: 。
发烟硫酸的组成及稀释问题
1.现有1L含SO3为30%的发烟硫酸(密度为1.95g/cm3),要把它稀释成浓度为95%的浓硫酸,要加水约为 ( )
A.120mL B.180mL C.240mL D.300mL
2.用浓H2SO4吸收SO3可以得到H2SO4·SO3,若用1000g98%的H2SO4充分吸收SO3后,再进行稀释,可得到98%的硫酸的质量是多少千克?
3.将三氧化硫溶解在硫酸中所得到的混合物叫做“发烟硫酸”,通常以发烟硫酸中三氧化硫的质量分数表示其组成。今将0.1185g发烟硫酸试样溶于水,用0.125 mol/L 的NaOH标准溶液滴定。用去此标准溶液20mL恰好中和,则试样中SO3的质量分数为 ( )
A.15% B.17% C.34% D.60%
4.H2SO4是SO3的水合物,设某种(90%)浓H2SO4存在着三种水合物形式:H2SO4(SO3·H2O),H2S2O7(2SO3·H2O),H2SO4·2H2O(SO3·3H2O),若H2SO4·2H2O的质量占了一半,那么H2SO4和H2S2O7的物质的量的比是 ( )
A.1:1 B.98:168 C.163:191 D.168:191
5.接触法制硫酸中,最后的产品是98%硫酸或20%发烟硫酸(可看作H2SO4和SO3的混合物,其中SO3的质量分数为20%)。
⑴若98%硫酸可表示为SO3·aH2O,20%发烟硫酸可表示为H2O·bSO3,则a、b的值(可用分数表示)分别是a= b=
⑵用m(H2O)=k×n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式分别是m1(H2O)= n1(SO3)、m2(H2O)= n2(SO3)。
⑶若工厂同时生产上述两种硫酸,则两种产品的质量比x(x=W1/W2,W1:98%硫酸的质量、W2:20%发烟硫酸的质量)与SO3用量之比的关系式是:n1(SO3)/ n2(SO3)= x。
硫酸的混合
1.将5x%的硫酸溶液与x%的硫酸溶液等体积混合后,其溶液中溶质的质量分数 3x%。(填大于、小于或等于)
2.将p%的浓硫酸与同体积的水混合,得到q%的稀硫酸,则p、q的关系正确的是( )
A.p≤q B.p=2q C.p>2q D.p<2q
3.(新)在100g浓度为18mol/L,密度为ρg/cm3的浓硫酸中加入一定量的水稀释成9 mol/L的硫酸,则加水的体积为 (A)
A.小于100mL
B.等于100mL C.大于100mL D.等于![]()
4.质量分数不等的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时为b%;质量分数不等的两种乙醇溶液等质量混合时,质量分数为a%,而等体积混合时其质量分数为c%,则a、b、c的大小关系为 ( )
A.a>b>c B.b>a>c C.c>a>b D.a>c>b
5.已知98%的浓硫酸的浓度为18.4mol/L,则49%的硫酸溶液的浓度为 ( )
A.9.2 mol/L B.大于9.2 mol/L C.小于9.2 mol/L D.不能确定
(新)将12mol/L的硫酸和4mol/L的硫酸等质量混合(忽略液体混合时体积的变化),则混合后溶液的物质的量浓度 (C)
A.大于8mol/L B.等于8mol/L C.小于8mol/L D.无法确定
实验
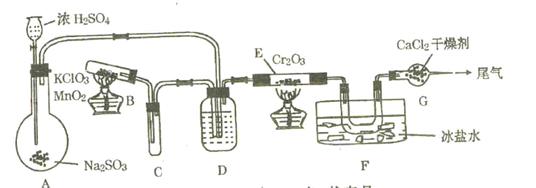
1.实验室中根据2SO2+O2![]() 2SO3;ΔH= —196.6KJ/mol。。设计如下图所示的实验装置来制备SO3固体。请回答下列问题:
2SO3;ΔH= —196.6KJ/mol。。设计如下图所示的实验装置来制备SO3固体。请回答下列问题:
⑴实验前,必须进行的操作是(填操作名称,不必写操作过程)
⑵在A装置中加入固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
⑶小试管C的作用是
⑷广口瓶D内盛的试剂是 ,装置D的三个作用是:①
② ③
⑸实验中当表面红热时,应将酒精灯移开一会儿再加热,以防止外温度过高,这样
做的原因是
⑹装置F中U型管内收集到的物质的颜色、状态是
⑺装置G的作用是
⑻从装置G导出的尾气的处理方法是用
 |
| 知识综合应用 |
1.高氯酸是最强酸。60%的高氯酸溶液加热不分解,但浓度再高就不稳定,受热易分解。热浓的高氯酸遇有机物易爆炸。纯高氯酸的沸点是130℃,现有70%的商品高氯酸,为使其进一步浓缩,所采取的正确措施是( )
A.加入浓硫酸后,再小心常压蒸馏 B. 加入浓硫酸后,再进行减压蒸馏
C.各仪器连接处的橡皮塞应塞紧 D. 各仪器连接处必须用玻璃磨口装置
2.硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g硫酸银。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268mol/LBaCl2溶液,计算充分搅拌后的溶液中Ag+的物质的量浓度。
(3)在(1)题烧杯中需加入多少升0.0268 mol/LBaCl2溶液,才能使原溶液中Ag+浓度降低至0.02mol/L。
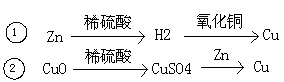 3.在实验室中,用Zn、CuO和稀硫酸为原料制取铜,有下列两种途径:
3.在实验室中,用Zn、CuO和稀硫酸为原料制取铜,有下列两种途径:
若用这两种方法制得铜的质量相等,回答下列问题:
(1)消耗氧化铜的质量大小关系① ②(等于、大于、小于)
(2)生成硫酸锌的质量大小关系① ②(等于、大于、小于)