高考化学II卷预测题
(一)实验部分
课本实验延伸题
预测1、(1)指出做下列实验时,从安全角度考虑必须进行的实验操作或加入的实验用品:
点燃氢气______________________________________
石油分馏_____________________________________
(2)有下列操作:
①用玻璃棒蘸取待测液少许沾在湿润的pH试纸上,测定溶液的pH。
②用稀硝酸洗涤做银镜反应时附着在试管壁上的银。
③液态氯乙烷试样加入稀氢氧化钠溶液煮沸,然后再加入硝酸银溶液检验氯元素。
④测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量。
⑤在某试样中加入盐酸酸化的氯化钡溶液有白色沉淀,可推论试样肯定有S042—。
⑥实验室配制氯化亚铁溶液时,将氯化亚铁晶体先溶解在较浓盐酸中,然后再用蒸馏水稀释并加入少量铁粉。
其中设计和推理均合理的是_______________________________(填序号)。
A、①②③④⑤⑥ B、②③④⑤ C、②⑥ D、⑥

实验评价
预测2、石蕊是一种色素,遇酸变成红色。为了验证二氧化碳不仅能溶于水,而且能与水发生反应,甲、乙两个同学分别设计了两组实验:
甲:将二氧化碳通入到紫色石蕊试液里,观察溶液颜色的变化。
乙:取四朵用石蕊溶液染成紫色的干燥的小花按下图进行实验:
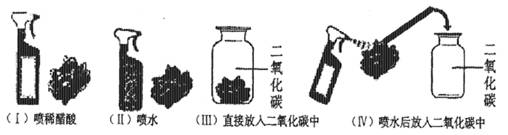
现请你对这甲、乙两个同学的方案进行评价。哪个更好?为什么?
你还有其它方案吗?,请写出你的实验方案(操作、现象和结论)。
预测3、在实验室中拟用氧化铜、稀硫酸、和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案。
甲:(1)CuO溶于适量稀硫酸中;
(2)在(1)的溶液中加入适量锌,充分反应后,过滤、烘干,即得纯净的铜。
乙:(1)锌与稀硫酸反应得氢气;
(2)将氢气通入氧化铜中并加热,充分反应后即得纯净的铜。问:
(1)若要制得相同质量的纯铜,甲乙所耗用的锌和稀硫酸是否相同?为什么?
(2)丙同学认为上述两种方案所制得的铜都难以保证铜的纯度,应对上述两种方案加以完善。你是否赞同丙同学的看法?为什么?你认为应怎样完善实验方案?
二、框图题
预测4、已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去)。
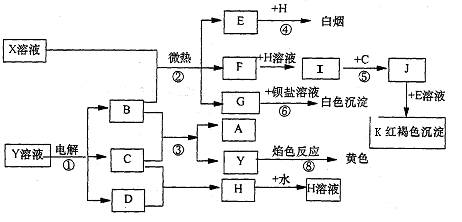
试回答:
(1)写出化学式:K:______ H:_____ (2)反应⑦中A溶液显示的性质是:___________
(填序号:A、氧化性;B、还原性;C、酸性;D、碱性)
(3)若X是一种复盐(不考虑结晶水) X的化学式为:____________
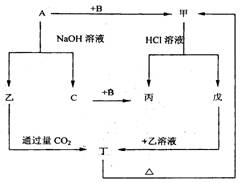 预测5、由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。
预测5、由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。
根据以上的转换关系回答:
(1)写出下列物质的化学式:A ,甲,乙,丁。
(2)写出甲物质在工业上的任两种主要用途
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式。
②乙与过量CO2反应的离子方程式
③戊溶液与乙溶液混合的离子方程式。
高考有机预测(请同学们特别注意官能团保护题)
有机合成中有时会遇到这样的情况,本意只想对某个官能团进行处理,结果却影响了其它官能团。“投鼠忌器”,防止对其它官能的影响,常常采用先保护后恢复的方法。
预测6、工业上用甲苯生产对羟基苯甲酸乙酯![]() ,其生产过各如下图:
,其生产过各如下图:
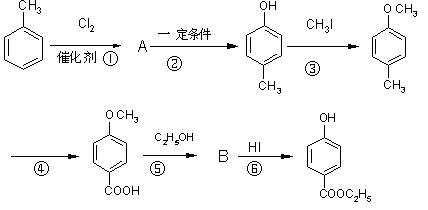
(1)有机物A的结构简式为_____________________。
(2)反应⑤的化学方程式:_____________________________________________。
(3)反应②的反应类型是__________(填编号,下同),反应④的反应类型属_________。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
(4)反应③的化学方程式:_______________________________________。
(5)在合成线路中,设计第③和⑥这两步反应的目的是:____________________________。
预测7、某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g 。若向此溶液中添加3.5 g氯化钠和6.5 g水,求所得溶液的溶质质量分数。
预测8、A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05mol在0.125molO2中恰好完全燃烧生成0.1molCO2和0.1molH2O。
(1)通过计算确定该混合物的组合可能有几种?
(2)另取一定量的A和B的混合物完全燃烧,且其中组分以任意比混合且物质的量之和一定。
①若耗氧量一定,则A和B的分子式分别的 、 。
②若生成的CO2和H2O的物质的量一定,则A和B的分子式分别是 、 。
预测9、在400K时,向有机物A的蒸气20mL中充入60mL氧气,引燃恰好完全反应,产生的CO2和H2O(气)的体积比为2:3,冷却到反应前的状况时,混合气体的密度比反应前减少1/5,试通过计算确定该有机物的分子式。
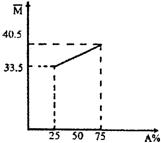 预测10、由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
预测10、由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
(1)A的相对分子质量为 。
(2)若测得混合气体中仅含两种元素,A、B都是无机物时,
化学式分别为 、 ;
A、B都是有机物时,化学式分别为 、 。
(3)某混合气由A、B等体积混合而成,将其与适量氧气混
合,引燃后反应物均无剩余,将产物依次通过足量浓H2SO4
(减少的体积恰好等于消耗氧气的体积、足量碱石灰(体积减半),又知通过浓H2SO4与通过碱石灰所减少的气体体积之比为5∶2。气体体积均在105℃和1.01×105Pa条件下测定的,据此确定混合气体的组成。
预测11、A、B、C为三种链烃,其碳原子数有如下组合:
| 组 别 | 碳原子数 | ||
| A | B | C | |
| ① | 3 | 3 | 6 |
| ② | 3 | 3 | 4 |
| ③ | 1 | 4 | 5 |
| ④ | 2 | 4 | 4 |
| ⑤ | 5 | 2 | 7 |
| ⑥ | 2 | 2 | 4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号) 。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1:1:2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积。
参考答案
1、 (1)检验氢气的纯度;加入碎瓷片 (2) C
2、略;3、(1)不相同。因为乙方案中氢气的作用除作还原剂外,还需用来排尽装置中的空气作保护气(防止铜再被氧化),所以乙方案中耗用的氢气多,所耗用的锌和稀硫酸就多。
(2)同意丙同学的看法。因为甲方案制得的铜中可能混有锌且过滤后未洗涤。改正方法是:“加锌充分反应后再加过量稀硫酸,不断搅拌至不再产生气体为止,静置、过滤并洗涤烘干。”乙方案制得的铜中可能混有氧化铜,改正方法是:“将所得铜粉中加入足量稀硫酸中,不断搅拌,充分反应后静置、过滤并洗涤烘干。”
4、(1)Fe(OH)3;HCl (2)AD(漏选一个得1分)
(3) (NH4)2Fe(SO4)2(只要NH4+、Fe2+、SO42-化合价代数和等于0均不扣分,否则扣分)
5、(1)Al Al2O3, NaAlO2 A1(OH)3,
(2)电解融熔冰晶石、氧化铝制单质铝,A1203可作耐火材料或刚玉可制成砂轮、研磨纸,红宝石、蓝宝石做精密仪器和手表的轴承。
(3)①2A1+2NaOH+2H20=2NaAl02+3H2↑
②AlO2- +C02+2H20=Al(OH)3↓+HCO3- ③Al3++3AlO2-+6H2O =4Al(OH)3 ↓
6、(1)![]() (2)
(2)![]()
(3)A;C(4)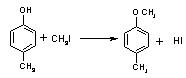
(5)第③将-OH转化为-OCH3,第⑥步将-OCH3转化为-OH(或“防酚羟基氧化”“保护酚羟基”).
7、添加的仍然是饱和的溶液,因此%=26.5%
8、(1)5 (2)①C2H2、C2H6O2 ②C2H4、C2H4O2 9、C2H6O(注意进行O数目的说明)
10、(1)44 (2)N2O NO C3H8 C2H6
(3)根据题意,混合气体平均相对分子质量为37;水蒸气和CO2体积比为5:2;产物中CO2和CO物质的量相等,设混合气体的平均组成为CxHYOz,则有:
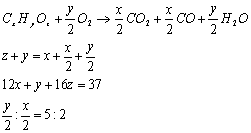
联立方程解得:x=2 y=5 z=0.5
则混合气体的平均组成为:C2H5O0.5 结合A、B的相对分子质量为44和30可推得此混合气体可能为C3H8和CH2O(甲醛)或C2H4O(乙醛)和C2H6
11.(10分)(1)①⑤⑥ (2)224mL