全国各地高考化学实验试题集
1.(浙江)
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
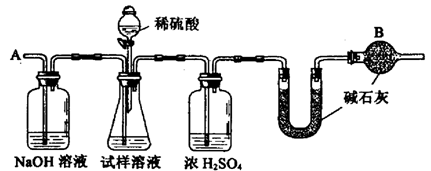
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴人6mo1·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明____________________
(2)装置中干燥管B的作用是__________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_____________(填偏高、偏低或不变)
(4)步骤⑤的目的是______________ (5)步骤⑦的目的是____________________
(6)该试样中纯碱的质量分数的计算式为_____________________________
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
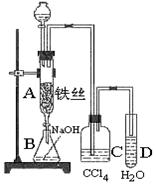
2.(理综北京)
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
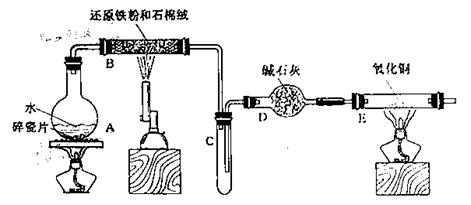
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
(1) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
![]()
滤液 FeCl3溶液 FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
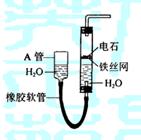
 3.(全国理综卷Ⅱ)
3.(全国理综卷Ⅱ)
下图中的实验装置可用于制取乙炔。
请填空:
(1) 图中,A管的作用是
,制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,
乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,
乙炔发生了 反应。
(1) 为了安全,点燃乙炔前应
乙炔燃烧时的实验现象是 。
(上海)
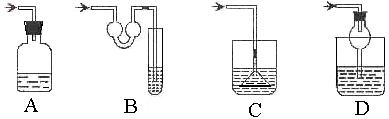
4、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
5、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A、 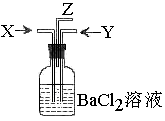 气瓶中产生的沉淀是碳酸钡
气瓶中产生的沉淀是碳酸钡
B、 Z导管出来的气体中无二氧化碳
C、 气瓶中产生的沉淀是硫酸钡
D、Z导管口有红棕色气体出现
6、(B)某化学课外小组用右图装置制取溴苯。
先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)  写出A中反应的化学方程式
写出A中反应的化学方程式
(2) 观察到A中的现象是 。
(3) 实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4) C中盛放CCl4的作用是 。
(5) 能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
7、硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸猴,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
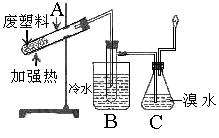 8、某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
8、某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
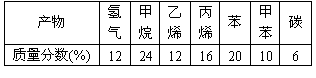 加热聚丙烯废塑料得到的产物如右表:
加热聚丙烯废塑料得到的产物如右表:
(1)试管A中残余物有多种用途,如下列转化就可可制取高聚物聚乙炔。
A中残留物聚乙炔
写出反应②~③的化学方程式 、 。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
9、(广东卷)
研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
 |
②实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________________________________;
②溴水溶液,现象是_______________________________________________________;
③硫化钠溶液,现象是_____________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
10、(黑、吉、桂)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有_______________(填代号,限填3项)。
A、试管 B、瓷坩埚 C、坩埚钳 D、铁三角架
E、泥三角 F、洒精灯 G、烧杯 H、墨筒
(2)第2步:Iˉ溶液的获取。操作是_________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用_________(填代号)。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
理由是__________________________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
|
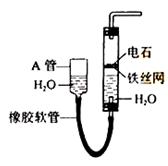
请填空:
(1)图中,A管的作用是
。
制取乙炔的化学方程式是
。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,
乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,
乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,
乙炔燃烧时的实验现象是
。