7.碳族元素 无机非金属材料
一、选择题(下列每小题只有一个选项符合题意)
1.向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量是:
(1) 0.001mol (2) 0.002mol (3) 0.003mol (3) 0.004mol。
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
2.把一定质量的碳和8g氧气在密闭容器中高温反应,恢复到原来的温度,测得容器内压强比原来大0.4倍。则参加反应的碳的质量为:
A、2.4g B、4.2g C、6.0g D、无法确定
3.在一定条件下,下列物质不能和二氧化硅反应的是:
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化亚铁 ⑧氮气
A.③⑤⑦⑧ B.⑤⑦⑧ C.⑤和⑧ D.只有⑤
4.“耐高温长寿命抗氧化陶瓷复合材料应用技术”获2004年度国家技术发明一等奖。该复合材料的强度比钢还大,在航空航天器中用来替代金属材料,可节约20~30%的燃料。下列关于该材料的叙述中不正确的是
A.该材料属于新型无机非金属材料 B.该材料的化学性质非常稳定
C.与金属一样有较好的传热性能 D.可以替代金属做耐高温结构材料
5、下列各组物质中:① C12O7 HClO ② SO2 H2SO4 ③ NO2 HNO3 ④ SiO2 H4SiO4 ⑤ Mn2O7 HMnO4,前者都是后者的酸酐,正确的是:
A.②③ B.③④ C.④⑤ D.①③④
6.将23g石英和60g石灰石在高温下反应,产生的气体在标准状况下的体积为:
A.5.6L B.1.2L C.13.44L D.6.72L
7、为了干燥CO2并除去混有的少量SO2,混和气应依次通过
A.碱石灰,溶H2SO4 B.烧碱,浓H2SO4
C.饱和小苏打溶液,浓H2SO4 D.碳酸钠溶液,浓H2SO4
8、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是( )
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl D.可能有CO2、NH3和水蒸气
9、下列几种情况都有白色沉淀物质生成,其中生成物的化学成分相同的是( )
(1)块状纯碱久置于空气中生成的白色粉末
(2)盛澄清石灰水的烧杯内壁附着的白色物质
(3)生石灰久置于空气中生成的白色物质
(4)Na2SiO3水溶液置于敞口容器中,溶液中出现的白色浑浊
A.(1)、(4) B.(2)、(3) C.(1)、(2) D.(3)、(4)
10、有一碱性溶液250mL,它可能是NaOH、Na2CO3、NaHCO3中的一种或两种.若加入足量的盐酸,产生的挥发性气体用Ba(OH)2溶液吸收,可得14.775g的白色沉淀物,另取同样体积的该碱性溶液,恰能使浓度为0.625mol/L的NaOH溶液100mL完全反应,该碱溶液的可能组成是( )
A.NaOH、Na2CO3 B.NaHCO3、Na2CO3 C.只含NaHCO3 D.只含Na2CO3
二、填空题
11、BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称.若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成 是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同.请填空:
(1)锗和铋的元素符号分别是 和 .
(2)BGO晶体中所含铋氧化物的化学式是 .
(3)BGO晶体的化学式是 .
12、某核素R具有微弱放射性,其原子核内中子数比质子数多43。由R组成的固体单质A,在一定条件下密度为6.88g/cm3。用x射线研究固体A表明,在边长为1.00×10-7cm的立方体中含有20个原子。R在化学反应中常表现为+2、+4价。在溶液中R2+稳定,而R4+有强氧化性。请回答:
(1) R原子的摩尔质量为_________________________;
(2) R元素位于周期表的第_______周期_________族,名称为________;
(3) 将SO2通入到黑色的RO2悬浊液中有白色沉淀生成,此反应的方程式为
_______________________________________________________;
(4) 在Mn2+的溶液中加入HNO3无明显变化,再加入RO2,溶液变紫红色;如果将HNO3改为盐酸,则不显紫红色。写出有关反应的离子方程式:
___________________________________________________________,
___________________________________________________________。
13、Ⅰ.实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答
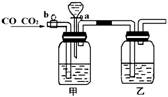
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
Ⅱ.在没有现成CO2气体发生器的情况下,请你选用如图中部分仪器装配成一个简易的、能随开随用的、随关随停的CO2气体发生装置.
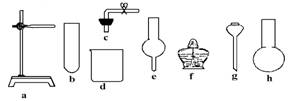
(1)应选用的仪器是(填入编号) .
(2)若用上面已装配好的实验装置制取CO2气体,而实验室只有稀H2SO4、浓HNO3、 水、块状纯碱、块状大理石.比较合理的方案,你认为应选的药品是________________________________________________________________.
14.要除去下表中各粉末状混合物中的杂质(括号内为杂质),填写所用试剂和操作:
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
三、计算题
15.自然界存在的碳酸类铜矿(如孔雀石、石青等)的化学组成为:aCuCO3·bCu(OH)2(a、b正整数,且a≤2,b≤2)。(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:孔雀石为4:1;石青为3:1。
则它们的化学式为:孔雀石:________________石青:
(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO2 3.36L(标准状况);加热B样品使其完分解,得到20g CuO。试计算并确定该矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO2 6.72L(标准状况),这份矿样中CuO含量不低于_________克。
(4)设某碳酸盐类铜矿样的质量为A克,所含CuO质量为G克。加酸完全溶解后,产生的CO2体积(标准状况)为V升,则含铜矿的A、V、G之间的关系式为:A=______________________________。
参考答案:
1-10 D B C C C C C C B B
11.(1)Ge、Bi (2)Bi2O3 (3)2Bi2O3·3GeO2或Bi4Ge3O12或Bi4(GeO4)3
12. (1).207g/mol;
(2).六 ⅣA 铅;
(3).PbO2 + SO2 = PbSO4
(4).5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4- +2H2O
PbO2 + 4H+ + 2Cl- = Pb2+ +Cl2↑ + 2H2O
13. Ⅰ.(1)NaOH 浓H2SO4 稀H2SO4 (2)CO;打开b,关闭a, (3)CO2,打开a,关闭b。
Ⅱ. (1)a、c、d、e (2)浓HNO3、水、块状大理石
14、
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | 盐酸 | 过滤 | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| CaCO3(SiO2) | NaOH溶液 | 过滤 | 2NaOH+SiO2=Na2SiO3+H2O |
| Fe(Si) | NaOH溶液 | 过滤 | 2NaOH+H2O+SiO2=Na2SiO3+2H2↑ |
| SiO2(H2SiO3) | / | 加热灼烧 | H2SiO3=SiO2+H2O |
15、⑴孔雀石:CuCO3·Cu(OH)2;石青:2CuCO3·Cu(OH)2;
⑵组成为:CuCO3·Cu(OH)2与2CuCO3·Cu(OH)2混合物;
⑶36克; ⑷A=124V/22.4+98(G/80-V/22.4)。