第4节 氧化还原反应
一、考点透视
本节要求正确理解氧化还原反应有关概念,掌握氧化性或还原性强弱比较的规律和氧化还原方程式配平的方法技巧,并能依据电子得失守恒关系进行有关计算。近几年高考试题主要涉及以下几个方面。
1、 氧化剂、还原剂、氧化产物、还原产物的判断;
2、 计算电子转移的数目;
3、 判断反应是否属于氧化还原反应;
4、 比较氧化剂的氧化性或还原剂的还原性的强弱;
5、 氧化还原反应的方程式的配平;
6、 依据质量守恒、电子、电荷守恒等解决一些计算型问题。
今后命题会继续在上述几方面进行,同时有可能推出新的题型、新的设问方式,特别是与工农业生产、日常生活、科学实验等实际相结合的知识。
二、小结与整合
1、基础内容 见《如东课堂突破》
2、判断物质氧化性、还原性的方法
总原则:物质的氧化性和还原性的强弱决定于元素得失电子的难易程度,与得失电子数的多少无关;物质越易得电子则其氧化性越强,物质越易失电子则其还原性越强。
(1) 根据金属活动性顺序判断:按金属活动顺序表从左到右,金属单质还原性逐渐减弱,对应金属阳离子氧化性逐渐增强。
(2) 根据反应条件难易判断:不同氧化剂与同一还原剂反应,反应条件越易,氧化性越强;不同还原剂与同一氧化剂反应,反应条件越易,还原性越强。
(3) 同一反应中,氧化剂和氧化产物都有氧化性,氧化性强弱:氧化剂>氧化产物;还原剂和还原产物都有还原性,还原性强弱:还原剂>还原产物。
(4) 根据与同种物质反应的情况判断:不同的氧化剂与同种还原剂反应,还原剂中元素被氧化的价态越高,该氧化剂的氧化性就越强。
3、氧化还原反应的重要规律
(1) 定量规律:在同一氧化还原反应中,氧化剂所得到的电子总数与还原剂失去电子的总数相等(化合价升高总数与化合价降低总数相等)。
(2) 反应先后规律:若溶液中同时含有几种还原剂,若加入氧化剂,则优先与氧化剂反应的是还原性最强的物质。
(3) 同种元素间的氧化还原规律:同种元素同种价态发生氧化还原反应时,其价态为中间变两头(一高一低);同种元素不同价态发生氧化还原反应,则为两头价态靠中间(只靠拢,不交叉)。
4、氧化还原反应方程式的配平 见《如东课堂突破》
三、实例引路
例1 G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) ①G→Q+NaCl,②Q+H2O→X+H2,③Y+NaOH→G+Q+H2O,④Z+NaOH→Q+X+H2O。这五种化合物中氯的化合价由低到高的顺序为( )
(A)Q、G、Z、Y、X (B)G、Y、Q、Z、X
(C)G、Y、Z、Q、X (D)Z、X、G、Y、Q
例2 将0.04molKMnO4固体加热一段时间后,收集到a mol气体,此时KMnO4的分解率为X。在反应后的残留固体中加入足量的浓盐酸,又收集到b mol气体(设Mn元素全部以Mn2+存在于溶液中)。试填写:
(1)a+b= (用X表示);
(2)当X= ,a+b取最小值且为 ;
(3)当a+b=0.09mol时,加热后所得残留固体的质量为 克。
例3 在P4+CuSO4→Cu3P+H3PO4+H2SO4的反应中,被1mol CuSO4氧化的白磷的物质的量是( )
A、1mol B、![]() mol
C、
mol
C、![]() mol D、
mol D、![]() mol
mol
例4 用氯气对饮用水消毒会使饮用水中的有机物发生氯代,生成有机含氯化合物,对人体有潜在的危害作用。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议采用广谱高效的二氧化氯(ClO2)。
(1)二氧化氯具有很强的氧化性,常被用作消毒剂,其消毒的效率(以单位质量得到的电子的物质的量表示),是Cl2的 倍。
(2)使用ClO2作饮用水消毒剂的优点是 。
(3)目前,欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半。表示这一反应的化学方程式是 。
(4)我国最近研究成功用Cl2氧化亚氯酸钠((氮气保护下)制得ClO2,表示这一反应的化学方程式是这一方法的优点是 。
(5)在H2SO4酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,表示这一反应的化学方程式是 。
例5(05上海)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
四、自我评估
1、对于反应H-+NH3=H2+NH2-的正确说法是( )
A、属于置换反应 B、H-是还原剂
C、NH3是还原剂 D、H2既是氧化产物又是还原产物
2、下列叙述中,正确的是( )
A、 含金属元素的离子不一定都是阳离子
B、 在氧化还原反应中,非金属单质一定是氧化剂
C、 某元素从化合态变为游离态时,该元素一定被还原
D、 金属阳离子被还原后不一定得到金属单质
3、过氧化氢与用硫酸酸化的KMnO4溶液(过量)反应,生成硫酸钾、硫酸锰、水、氧气,如果过氧化氢中的氧原子是用带放射性的示踪原子(18O),则反应完毕后,18O将会出现在( )
A、K2SO4中 B、MnSO4中 C、H2O中 D、O2中
4、已知铋酸钠(NaBiO3)在酸性条件下可以将Mn2+氧化为MnO4-,则下列溶液中不能用于酸化铋酸钠溶液的是( )
A、HNO3 B、NaHSO4 C、HCl D、H2SO4
5、R2O8n-离子在一定条件下可以把Mn2+氧化为MnO4-离子,若反应后R2O8n-离子变成RO42-,又知反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中R元素的化合价为( )
A、+3 B、+5 C、+6 D、+7
6、ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A、1:1 B、2:1 C、1:2 D、2:3
7、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+; MnO4-→Mn2+;Cl2 →Cl-;HNO2→NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A、Fe3+ B、 MnO4- C、Cl2 D、HNO2
8、某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )
A、NO2 B、NO C、N2O D、N2
9、已知氯化溴能发生下列反应:nBrCl+2M![]() MCln+MBrn BrCl+H2O
MCln+MBrn BrCl+H2O![]() HBrO+HCl
HBrO+HCl
下列推断中错误的是 ( )
(A)BrCl的化学性质与Cl2、Br2等相似
(B)BrCl在与水的反应中,BrCl既是氧化剂又是还原剂
(C)BrCl分子中一定存在有极性共价键
(D)BrCl容易与NaOH反应生成NaClO和NaBr
10、14克铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12升(标况)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量是( )
A、9.6克 B、6.4克 C、3.2克 D、1.6克
11、1.92g铜投入一定量的浓HNO3,铜完全溶解,共收集到6.72气体(标准状况),将盛有此气体的容器倒扣在水中,通入一定量的O2(标准状况),恰好使气体完全溶于水中,则通入O2的体积是( )
A、504mL B、168 mL C、336 mL D、224 mL
12、在3BrF3+5H2O=HBrO3+Br2+9HF+O2反应中若有5mol水作为还原剂时,被水还原的BrF3的物质的量是( )
A、3mol B、1.5mol C、7.5mol D、10/3 mol
13、(05江苏)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
14、(05江苏)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
15、(05理综)等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
16、实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1 mol CuI参加反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
Cu2++ I-→ CuI+ I3-
17、俗话说:“饭后一苹果,疾病远离我。”吃水果能帮助消化,当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,好像生了“锈”一般,其原因是果肉里的酚在空气中转变为二醌,这些二醌很快聚合成为咖啡色的聚合物。
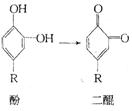
①这一变化(酚变为二醌)的反应类型为 (填序号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
②若要避免苹果“生锈”,请你选择一种保存切开的苹果的方法, ,
其原因是 。
18、为了测量水中有机物等还原性污染物的含量,通过把1L水样与强氧化剂完全作用时消耗氧化剂的量,折算成以氧气为氧化剂时的质量(O2mg•L-1)来表示,称为该水样的化学耗氧量(COD)。我国明文规定:COD>500 mg•L-1的污水不得直接排放。 为了测定某工业废水的COD,实验如下:量取废水样品20.00mL,加入0.100mol•L-1KMnO410.00mL和少量稀H2SO4,在一定条件下充分反应后,再用0.200 mol•L-1的草酸钠(Na2C2O4)溶液滴定过量的KMnO4,达到滴定终点时消耗Na2C2O4溶液11.00mL。
(1)写出酸性介质中KMnO4(被还原为Mn2+)与Na2C2O4(被氧化为CO2)反应的离子方程式 。
(2)计算该水样的COD,写出计算过程 。
(3)如果每次取水样20.00mL,加入等体积的0.100 mol•L-1 KMnO4酸性溶液;为简化计算,令滴定过量KMnO4时,每消耗1.00mL Na2C2O4溶液,就相当于水样的COD为10mg•L-1,该Na2C2O4溶液的物质的量浓度应配制为多少?
第4节 氧化还原反应答案
例题:1、C 2(1)0.1-0.02X (2)0.08 (3)6 3、 C
4(1)2.63
(2)一是ClO2的消毒效率高,二是ClO2不会和水中有机物生成对人体有害的含氯化合物。
(3)2 NaClO3+4HCl==2NaCl+Cl2↑+2ClO2↑+2H2O
(4)Cl2+2NaClO2==2NaCl+2ClO2↑ 无Cl2杂质,质量好,产率高。
(5) Na2SO3+2 NaClO3+H2SO4== 2Na2SO4+2ClO2↑+H2O
5、(1)H2O2
(2)H2CrO4 Cr(OH)3
(3)2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
(4)3.36L
评估:
1、BD 2、AD 3、D 4、C 5、D 6、B 7、B 8、C 9、BD 10、C 11、C
12、D 13、A 14、A 15、A
16、(1)+1 (2)CuI 0.5 (3)2 5 2 1
17、① a
② 放入水中,因切开的苹果易被氧化,放入水中,使果肉不与空气接触,减缓氧化速率。
18、(1)2MnO4-+5C2O42-+16H+==2Mn2++8H2O+10CO2↑
(2) 5C2O42- ~ 2MnO4-
5 2
11.00×10-3×0.2mol 0.4×0.2×11.00×10-3mol
用于与草酸钠反应的MnO4-为0.4×0.2×11.00×10-3=8.8×10-4mol,则与水样反应的MnO4-为10.00×10-3×0.1-8.8×10-4=1.2×10-4 mol,则换算成氧气
4MnO4- ~ 5O2
4 5
1.2×10-4 mol 1.25×1.2×10-4 mol
则氧气为1.25×1.2×10-4 mol,质量为1.25×1.2×10-4 mol×32g/ mol=4.8×10-3 g=9.6mg
则该水样的COD为4.8 mg/0.020L=240mg/L
(3)水样的COD=10mg/L,则20.00mL水样中,m(O2)=10/50mg=0.2mg,
为0.2×10-3g÷32(g/mol)=6.25×10-6mol
4MnO4- ~ 5O2
4 5
0.8×6.25×10-6mol 6.25×10-6mol
则与草酸钠反应的MnO4-为2×10-3mol-0.8×6.25×10-6mol=2×10-3mol,
2MnO4- ~ 5C2O42-
2 5
2×10-3mol 5×10-3mol
则C(Na2C2O4)=5×10-3mol÷(1×10-3L)=5.00mol/L