高考适应性考试化学试题
化 学 试 题
第I卷 (选择题 共72分)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Cl:35.5
Cu:64 Ag:108
一、选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.据2004年5月15日媒体报道,广东又发生了一起严重的假酒中毒事件,使人们不禁回想起了1997年山西的假酒事件。假酒中引起中毒的物质的同类物质是
A.CH3OH B.HCHO C.HCOOH D.CH(OH)(CH2OH)2
2.1996年2月,德国某研究所在高能加速器中,将![]() 撞入一个
撞入一个![]() 的原子核,释放出一个中子后得到一种超重元素的原子;该元素原子核内中子数为
的原子核,释放出一个中子后得到一种超重元素的原子;该元素原子核内中子数为
A.278 B.277 C.166 D.165
3.化学酱油是利用豆饼粉与20%盐酸加水加热沸腾数十小时后成为酱色液体,冷却后加入饱和碳酸氢钠溶液搅动,再经脱色即成。下列说法不正确的是
A.豆饼含丰富的蛋白质,加盐酸加热是为了加速蛋白质的水解
B.蛋白质水解后可生成20多种氨基酸 C.加饱和碳酸氢钠溶液是为了消耗盐酸
D.最后将氯气通入酱油,目的是漂白脱色
4.下列鉴别有关物质的方法,不可行的是
A.只用滴管和试管可以鉴别硫酸铝溶液和氢氧化钠溶液
B.加入Ba(NO3)2溶液,析出白色沉淀,继续加过量的稀HNO3,沉淀不消失,证明溶液中含有SO42-
C.用盐酸、苛性钠、氯化钠溶液中的任何一种作试剂都能鉴别开碳酸氢铵和氯化镁两种溶液
D.用pH试纸可以鉴别醋酸钠、氯化钾和硫酸氢钠三种溶液
5.下列粒子中,所有原子都满足最外层为8电子结构的是
A.(CH3)3C+ B.PCl3 C.BeCl2 D.NaOH
6.下列物质中,可溶于水的是
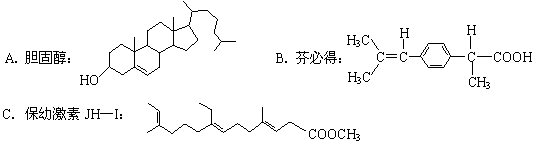 |
 |
7.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱
8.将质量分数为a%的NaOH溶液蒸发掉mg水后,变成vmL 3a%的NaOH溶液(蒸发过程中
无晶体析出),则蒸发后所得溶液的物质的量浓度是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,11.2L的氮气和氨气的混合气体的原子总数为3NA
B.标准状况下,1mol石英晶体中所含硅氧(Si-O)键的数日为4NA
C.标况下气体摩尔体积约22.4L/mol,非标准状况下气体摩尔体积不可能是22.4L/mol
D.常温常压下,16g甲烷与氯气发生取代反应最多需要氯气的分子数为4NA
10.周期求中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),如Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氯气。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A.电解时产生的无色气体是O2
B.电解前LiCl在加热时已发生水解
C.无色气体为电解生成的锂与水反应放出的H2
D.无色气体是阳极放出的C12与水作用生成的O2
11.在含有S2—离子,且滴加酚酞显红色的溶液中,能大量共存的离子组是
A.NH4+、Ba2+、C1—、AlO2— B. SO42—、NO3—、Fe2+、A13+
C.C1—、SO32—、Na+、K+ D.Na+、K+、C1O—、Cl—
12.能正确表示下列化学反应的离子方程式是
A.Fe(OH)3溶于HI溶液中:Fe(OH)3十3H+== Fe3+十3H2O
B.除去了表面氧化膜的铝片插入氯化铜溶液中:Al十Cu2+== A13+十Cu
C.碳酸钙溶于盐酸中:CaCO3十2H+==Ca2+十CO2↑十H2O
D.碳酸钠溶液呈碱性:CO32—十H2O== HCO3—十OH—
13.某溶液中含有NaOH、Na2CO3两种物质、且NaOH的物质的量大于Na2CO3的物质的量;取适量该溶液向其中滴加盐酸.以放出的CO2的量为纵轴,以参加反应的HCl的量为横轴作图,则下列图象中可能正确的是
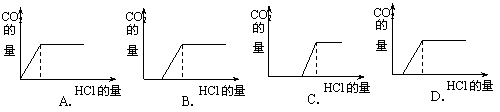 |
14.已知C3N4晶体很可能具有比金刚石还大的硬度,且每个原子间最外层均满足8e
稳定结构。下列关于C3N4晶体的说法正确的是
A.C3N4晶体可能是分子晶体,晶体中微粒间通过共价键相结合
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原于连接4个N原于,每个N原于连接3个C原于
D.C3N4晶体中每个N原于上还有2个未共用的电子
15.1molX气体跟amol Y气体在体积可变的密闭容器中发生如下反应:X(g)十aY(g)![]() b Z(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度3/4,则a和b的数值可能是
b Z(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度3/4,则a和b的数值可能是
A.a=1, b=2 B.a=2, b=1 C.a=2, b=2 D.a=3, b=2
16.现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
20℃ 50℃
A的溶解度 35.7g 46.4g
B的溶解度 31.6g 108g
下列说法中,正确的是
A.可采用重结晶法使A、B混合物分离
B.若把108g B的饱和溶液从50℃降到20℃,析出的B是76.4g
C.在20℃时,A、B都可以配成溶质质量分数为25%的不饱和溶液
D.两种盐在某一温度下具有相同的溶解度
17.有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀 溶液。电解时当甲池电极析出1.6gCu时,乙池电极析出0.54g金属,则乙池的溶质可能是
A.AgNO3 B.Cu(NO3)2 C.Mg(NO3)2 D.Al(NO3)3
18.从矿物学家资料查得:当胆矾溶液渗入地下遇硫铁矿(FeS2)时,可以生成辉铜矿(Cu2S),同时,还生成FeSO4和H2SO4化学方程式如如下:
14CuSO4十5FeS2十12H2O=7Cu2S十5FeSO4十12H2SO4
对上述事实的下列分析,正确的是
A.FeS2既是氧化剂又是还原剂
B.Cu2S既是氧化产物又是还原产物
C.在上述反应中,每生成1 mol Cu2S时,共得到2 mol电子
D.在上述反应中,每5 mol FeS2反应生成5 mol FeSO4时,共失去21 mol电子
第II卷 (非选择题 共78分)
三、本题包括2小题,共20分
19.(8分)⑴某学生在实验报告中写出以下的实验操作或实验数据,你认为其中合理的是
(填代号)
A.用托盘天平称取29.25g的食盐
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌
C.用氯化亚铁晶体配制FeCl2溶液时还需加入稀盐酸和铁粉
![]() D.用湿润的pH试纸测得某溶液的pH为10
D.用湿润的pH试纸测得某溶液的pH为10
E.在比较H2O、CH3COOH、CH3CH2OH、 等分子中—OH上氢原子活性的时候,加入的物质和顺序是⑴NaHCO3,⑵NaOH,⑶Na。
F.将生香蕉和熟香蕉捆在同一个塑料袋中,生香蕉很快变熟了,这主要因为“温室”效应造成的
⑵某甲酸溶液中,可能混有甲醛,如何通过化学实验来证明其中是否有甲醛。写出简要的操作步骤:
。
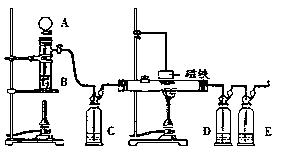 20.(12分)下图是用浓H2SO4和HCOOH制备CO还原Fe2O3并检验反应产物的实验装置图。
20.(12分)下图是用浓H2SO4和HCOOH制备CO还原Fe2O3并检验反应产物的实验装置图。
⑴A、B、C、E中应分别盛放
、 、 、
⑵制备CO的方程式为 ;
⑶加热还原Fe2O3之前首先要做 检验;然后还要做 试验,检验 是否被赶净;
⑷磁铁要在反应 (填“前”或“后”)才能吊在玻璃管上方,它的作用是
。
⑸D中所放物质为CuCl-NH3溶液,它的作用是 。
四、本题包括2小题,共20分
21.(12分)已知X、Y、H、G、J均为三种由短周期元素构成的粒子,其结构特点如下:
| 粒子代码 | X | Y | H | G | J |
| 原子核数 | 单核 | 双核 | 双核 | 三核 | 双核 |
| 电子数 | 10 | 10 | 18 | 10 | 15 |
| 粒子的电荷数 | 1个单位正电荷 | 1个单位负电荷 | 0 | 0 | 0 |
物质A由X、Y构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示:
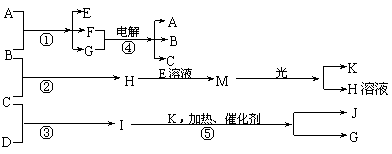 |
请填写下列空白:
⑴A的电子式为 ,从晶体结构的角度看,固态G的密度比液态G小的原因是
。
⑵反应①~⑤都可用于工业生产,其中反应⑤是工业制取 的基础,反应④的阳极反应式为 。工业上,向B的水溶液中加入CaCO3粉末可制取M,简要描述其化学原理 。
⑶标准状况下,若11.2L C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则H气体完全分解的热化学方程式为 。
22.(8分)已知温度为TK、压强为pkPa时,往容积可变的密闭容器中充入2 molX和1 mol Y,此时容积为VL。若保持恒温恒压,经5min,反应![]() 达到平衡,此时Z的体积分数为0.4。试回答下列问题:
达到平衡,此时Z的体积分数为0.4。试回答下列问题:
⑴达到平衡时,Y的物质的量为 mol。
⑵保持温度和压强在上述条件下恒定不变,再向上述密闭容器内充入4 mol Z,则反应达到平衡,容器的容积为 ,Z的体积分数为 。
⑶若另选一容积固定不变的密闭容器,仍控制温度为TK,使4 mol X和2 mol Y反应,达到平衡状态时,Z的体积分数仍为0.4,则该密闭容器的容积为 L。
五、本题包括2小题,共20分
![]()
|
 |
⑴请写出A、B、C的结构简式:A B C
⑵化合物B的系统命名为: 。
⑶含有三氟甲基和苯环的 的所有同分异构体数目为 。
24.(10分)宇航员佩戴头盔壳由聚碳酸酯制成,具有隔音、隔热、防碰撞、减震性好、质量小等特点。已知:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应
活性,易跟某些含羰基的化合物 (R、R’代表烷基或H原子)发生缩合反应生成
 新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
下图是合成聚碳酸酯的过程(反应条件和部分产物未写出)
试回答问题:
⑴上述合成聚碳酸酯的化学反应中,属于加成反应的是 ,属于消去反应的是 。
⑵X的结构简式 ,X和浓溴水反应时,1 mol X最多能消耗Br2 mol。
⑶在一定条件下X与 反应合成聚碳酸酯的化学方程式:
。
六、本题包括2小题,共18分
25.氢氧化镁难溶于水,但它所溶解的那一部分则在溶液中完全电离。某温度时,饱和氢氧化镁溶液(溶液的密度为1.0g/cm3)中的c(Mg2+)=5×10-4mol / L ,若不考虑水的离子积KW值的变化,请填写下列空白:
⑴该溶液中OH-离子的物质的量浓度为 。
⑵该溶液中的溶质的质量分数为 。
⑶该温度下氢氧化镁的溶解度是 。
26.(12分)取0.1 mol某烷烃A完全燃烧,将生成物依次通过浓H2SO4和碱石灰,浓H2SO4、碱石灰分别增重5.4g、8.8g。B为烃的含氧衍生物,分子中的碳原子数不多于A,而相对分子质量比A多16n(n为正整数)。
⑴据此推断:A的分子式是 。B可能是 、
、 (填写你熟悉的物质结构简式)。
⑵若A的同系物A’与B的某一种物质混合,在150℃、1.01×105Pa条件下,取1 L该混合气体与9 L O2混合充分燃烧,恢复至原状况测得燃烧后气体体积比燃烧前增加了4%,则时生成1 L CO2,由此推断A’与B各是什么物质?原1 L 气体中A’与B的物质的量之比是多少?