高考专题—化学计算单元综合测试
【单元综合测试】
一、选择题(每小题4分共32分,每小题只有一个选项符合题意。)
1.充分燃烧某有机物2摩尔,用去16摩尔O2,生成14摩尔CO2和144g水,该有机物的分子式是( )
A.C7H8O B.C7H8O2 C.C7H16O D.C7H14O
2.在25℃时,向5瓶盛有95g水的烧杯中加入或通入各5g下列物质:①NaCl ②NH3 ③ P2O5 ④CaO ⑤Na2 CO3·10H2O分别得到5种溶液。则5种溶液中溶质的质量分数关系为( )
A.③>①=②>⑤>④ B.③>①>②>④>⑤
C.④>③>①=②>⑤ D.①=②=③=④=⑤
3.将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g·cm-3),用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止通电,则此时应符合的关系是( )
| NaOH的质量分数 | 阳极析出物的质量(g) | 阴极析出物的质量(g) |
| A.0.062(6.2%) | 19 | 152 |
| B.0.062(6.2%) | 152 | 19 |
| C.0.042(4.2%) | 1.2 | 9.4 |
| D.0.042(4.2%) | 9.4 | 1.2 |
4.X、Y、Z为三种气体,把a molX和b molY充入一密闭容器中,发生反应X+3Y=2Z达 平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则X的转化率为( )
A.![]() ×100%
B.
×100%
B.![]() ×100%
×100%
C.![]() ×100%
D.
×100%
D.![]() ×100%
×100%
5.某碳氢化合物 A分子中含有双键,为饱和WgA中的双键,需要t℃,P帕下的氢气V升,如果用M表示A的相对分子质量,则A分子中,双键数目表示为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
6.bg某金属与足量的稀硫酸反应,生成该金属的三价正盐和ag氢气,则该金属的相对原子质量为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7.在无土栽培中,需配制一定量含50molNH4Cl、16molKCl和24molK2SO4的营养液。若用NH4Cl、KCl和K2SO4三种固体为原料配制,三者的物质的量依次是(单位为mol)( )
A.2、64、24 B.64、2、24 C.32、50、12 D.16、50、24
8.将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
二、选择题(每小题4分共40分,每小题有一到二个选项符合题意。)
9.PCl5在密闭容器中有反应:PCl5(g)=PCl3(g)+Cl2(g)。t1℃时P Cl5的分解率为48.567%,t2℃时分解率为97.034%。则t2℃时反应体系的物质的量是t1℃时反应体系的多少倍( )
A.0.4 B.1.3 C.1.6 D.1.9
10.800℃时,将1摩尔CO和1摩尔H2O(g)通入2升密闭容器中进行反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
达到平衡时,测得容器内CO2为0.3mol/L,此时再向容器内通入1molH2O(g),并保持温度不变,则达到平衡时CO2的物质的量可能是( )
A.0.3mol B.0.6mol C.0.9mol D.1.2mol
11.某金属元素R的硝酸盐R(NO)3n溶液用Pt电极电解,阳极产生气体VL(标准状况下)时,阴极质量增加mg,若R的相对原子质量为M下列叙述中不正确的是( )
A.电路中通过电子![]() mol
B.n=
mol
B.n=![]()
C.溶液中H+增加![]() mol
D.n=
mol
D.n=![]()
12.还原2.4×10-3molXO(OH)3-解X元素的低价态时,消耗0.2mol/L的Na 2SO3溶液30mL,则X元素的低价态是( )
A.+1 B.-1 C.0 D.-2
13.25℃时,在0.1mol/L的NaX溶液中,水的电离度为a1,在0.1mol/L盐酸中,水的电离度为a2,若![]() =109,则该NaX溶液的pH为( )
=109,则该NaX溶液的pH为( )
A.4 B.7 C.10 D.13
14.Mg、Al、Fe三种金属的混合物与足量的稀硫酸反应,生成2.80LH2(标准状况)则三种金属的物质的量之和不可能是( )
A.0.120mol B.0.150mol C.0.0800mol D.0.100mol
15.标准状况下,在一活塞式的密闭容器中,充入2.24L的NO,再小心充入1.12L O2 ,反应完毕,仍恢复至标准状况,则下列各项叙述中不正确的是( )
A.气体体积仍为2.24L
B.气体体积应小于2.24L
C.该气体在标准状况下的密度为2.05g·L-1
D.该气体在标准状况下的密度大于2.05g·L-1
16.在反应2X+5Y=4R+2M中,已知R和M的摩尔质量之比为22∶9,当2.6gX与Y完全反应,生成4.4gR,则在此反应中Y和M的质量比为( )
A.26∶9 B.39∶9 C.40∶9 D.53∶9
17.将物质的量相等的硫酸铵和硫酸铝溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
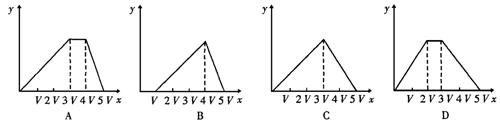
18.常温下,向20升真空容器内通入a摩尔硫化氢和b摩尔二氧化硫,反应完全后,容器内气体密度最大时的硫化氢与二氧化硫的物质的量的比是( )
A.2∶1 B.1∶2 C.2∶3 D.3∶2
三、(本题包括2小题,共19分)
19.(7分)已知由硫酸铁和硫酸亚铁组成的混合物中,硫元素的质量分数为a%,则铁元素的质量分数为__________。
20.(12分)计算以下两个小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压强为pPa的情况下,19.5gA和11.0gB恰好完全反应,生成固体C和3.00L的D气体。计算生成的C的质量(m)。缺少的数据是:__________,计算式为m=__________。
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积(V(H2))。缺少的数据是:__________,计算式为__________。
四、(本题包括2小题,共20分)
21.(10分)工业上用焦炭、水和空气为原料合成氨,在理论上消耗焦炭和氨气的物质的量之比为多少(不考虑空气中O2的反应)?
22.(10分)镁带在空气中完全燃烧后,将其产物溶于50mL 1.8mol/L稀盐酸中,再加 入20mL0.9mol/LNaOH溶液以中和多余的酸,然后加入足量NaOH溶液使氨全部逸出,经测定氨的质量为0.102g。求镁带的质量。
五、(本题包括2小题,共20分)
23.(10分)已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其相对分子质量以3.60×103计)0.504g。试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0计)
24.(10分)将NaHCO3和部分风化的纯碱晶体组成的混合物样品m克配成250mL溶液,用1.0mol/L盐酸滴定,至终点时,用去盐酸30.0mL。若将上述样品mg加热至质量不变时,可得到固体多少克?
六、(本题包括2小题,共19分)
25.(9分)取5.4g某碱金属和其氧化物组成的混合物,使之与足量水充分反应,蒸发反应后的溶液,得8g无水晶体。试确定该碱金属。
26.(10分)将一定量由碳、氢、氧三种元素组成的有机化合物A的蒸气与3.2g氧气混合点燃,再将生成的气体依次通过①盛有浓硫酸的洗气瓶②灼热的氧化铜③饱和石灰水(设 每个装置中的反应物均过量)。经测定①中增重3.60g ②中减重1.60g ③中增重8.80g。A 蒸汽的密度为3.393g/L(已换算成标准状况)。又测知A既能与碳酸钠溶液反应又能与金属钠反应,且均有气体生成,但分别得到的气体在相同条件下体积不同。
试求该有机物的分子式,并写出其可能的结构简式。

参考答案
【单元综合测试】
1.B 2.A 3.B 4.C 5.D 6.C 7.B 8.C 9.B 10.C 11.D 12.A 13.C 14.B、C 15.A、C 16.C 17.A 18.A
19.(7分)1-3a%
20.(12分)(1)根据质量守恒定律,欲求C的质量,须知道D的质量,题中已给出t0C和p Pa时D的体积,根据m=V![]() 公式知缺少的数据是“t℃、p Pa时D气体的密度ag/L”。计算式为:
公式知缺少的数据是“t℃、p Pa时D气体的密度ag/L”。计算式为:
m=19.5g+11.0g-3.00L×ag/L
(2)这是过量计算题的新发展,必须通过比较Mg和HCl的物质的量,判断哪种物质过量。缺少的数据是:“盐酸的物质的量浓度bmol/L”。由于字母b的不确定性,必须进行讨论。计算式为:
①当![]() ≤
≤![]() 时,V(H2)=
时,V(H2)=![]() ×22.4L/mol;
×22.4L/mol;
②当![]() >
>![]() 时,V(H2)=
时,V(H2)=![]() ×22.4L/mol。
×22.4L/mol。
21.(10分)3∶2。(运用电荷守恒法)
22.(10分)0.792g(运用质量守恒法和整体思维技巧)
23.(10分)
n(P2Mo24O77)=![]() (3分)
(3分)
其中P的质量为![]() (3分)
(3分)
P的质量分数=![]() =0.0843(或8.43%)
=0.0843(或8.43%)
若直接列出总式,同样给分:
24.(10分)15.9g (运用质量守恒法)
25.(9分)Na (运用讨论法)
26.(10分)
解:A的摩尔质量为3.393g/L×22.4L/mol=76g/mol (1分)
由浓硫酸增重可知一定量A中氢原子的物质的量:![]() ×2=0.4mol (1分)
×2=0.4mol (1分)
由氧化铜减重可求知一氧化碳的物质的量:![]() =0.1mol
(2分)
=0.1mol
(2分)
由石灰水增重可求知二氧化碳的物质的量:![]() -0.1mol=0.1mol (2分)
-0.1mol=0.1mol (2分)
一定量A中氧原子的物质的量为![]() =0.3mol
=0.3mol
(2分)
所以A的分子式为C2H4O3,其式量为76
由A的摩尔质量为76g/mol确定其分子式为C2H4O3。 (1分)
![]()