高考综合科化学试题集
一、单项选择题:
1.近年来,我国某些地区出现了私自滥采黄金的现象,提炼过程一般要使用化学药品氰化物,其直接后果是:a.污染水体 b.破坏臭氧层 c.危害工人的生命与健康 d.破坏植被(2000年):
A.ab B.abc
C.bd D.acd
2.下列化学品中属有毒且易燃的是(2000年):
A.乙酸 B.氰化钾 C.甲醇 D.氢气
3.绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)(2000年):
A.![]() +C2H5Cl
+C2H5Cl![]()
![]() +HCl
+HCl
B.![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
C.![]() +
+![]()
![]()
![]()
D.![]()
![]()
![]() +HBr
+HBr
![]() +H2
+H2![]()
![]()
4.下列现象的产生与人为排放大气污染物氮氧化物无关的是(2000年):
A.闪电 B.光化学烟雾 C.酸雨 D.臭氧层空洞
5.某离子含有6个电子、7个中子,静电荷数为0,则它的化学符号可能是(2001年):
A.13Al B.13Al C.13C D.13C
6.关于元素周期律和周期表的下列说法,正确的是(2001年):
A.目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
7.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法中正确的是(2001年):
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂
C.二氧化氯是离子化合物 D.二氧化氯分子中氯为负1价
8.二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等的致冷剂。试判断二氟甲烷的结构简式(2001年):
A.有4种 B.有3种 C.有2种 D.只有1种
9.苯甲酸(C6H5COOH)和山梨酸(CH3-CH=CH-CH=CH-COOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是(2001年):
A.金属钠 B.氢氧化钠 C.溴水 D.乙醇
10.石灰在工农业生产和建筑业上有着重要用途。用于生产石灰的主要原料是石灰石(用①表示),在石灰窑中加热焙烧石灰石得到生石灰(用②表示)并放出气体(用③表示)。生石灰在建筑业上主要用作粘合剂,一般先使它“熟化”变成熟石灰(用④表示),熟石灰与砂子混合成灰泥用于砌筑砖墙。经过一段时间后灰泥中的熟石灰变成另一固体物质(用 ⑤表示)。用下列化学式表示这5种物质都正确的是(2001年):
A.①Ca(OH)2 ②CaO ③SO3 ④CaSO4 ⑤CaSO4
B.①CaO ②Ca(OH)2 ③CO ④CaCO3 ⑤CaSiO3
C.①CaCO3 ②CaO ③CO2 ④Ca(OH)2 ⑤CaCO3
D.①CaCO3 ②CaO ③SO2 ④CaSiO3 ⑤Ca(OH)2
11.美国劳仑斯国家实验室曾在1999年宣布用86Kr离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文。但是科学家们相信,完成的第七周期包含的元素数目与第六周期相同。若118号元素将来被确认,则下列预测合理的是(2002年):
A.它的中子数是118 B.它是第八周期元素
C.它是活泼的金属元素 D.它的最外层电子数是8
12.下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是(2002年):
A.碘和碘化钠 B.金刚石和重晶石
C.冰醋酸和硬脂酸甘油酯 D.干冰和二氧化硅
13.向浓度都是1 mol·L-1的氯化铁、氯化亚铁和氯化铜混合溶液中加入铁粉,反应完全后铁粉还有剩余,则此溶液中浓度最大的阳离子是(2002年):
A.H+ B.Fe2+ C.Fe3+ D.Cu2+
14.把少量CO2分别通入到浓度相同的①Ba(NO3)2溶液;②Ba(OH)2溶液;③溶有氨的BaCl2溶液中。预计能观察到白色沉淀的溶液是(2002年):
A.②和③ B.只有②
C.①和② D.只有③
15.将H2、N2、O2三种气体分别放入不同的容器中,使它们的温度、密度相同,则其压强(p)大小的关系,符合(原子量:H 1 N 14 O 16)(2002年):
A.p(H2)> p(O2)> p(N2) B.p(O2)> p(N2)> p(H2)
C.p(H2)> p(N2)> p(O2) D.p(N2)> p(O2)> p(H2)
二、填空题:
16.(2000年)对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学以应如下:
2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体成分是_____,上述反应中的氧化剂是_____,还原剂是_______。
17.(2000年)人类活动可经由多种途径增大大气中的CO2,请写出下列会产生CO2的化学反应方程式:
a.石灰窑生产石灰:
b.煤炭燃烧:
c.汽油燃烧:
18.(2001)汽车工业同能源工业的发展有着密切的关系。由石油炼制可得到汽油、煤油和柴油等燃料。它们的主要成份是___________ _____类化合物。在汽车尾气中,造成大气污染的主要物质是_________________和_________________。目前有些国家使用甲醇替代汽油作发动机燃料,甲醇燃烧的化学方程式是______ ______ ______ ____ ____________。
氢气最有希望成为未来汽车的理想燃料,氢气作为燃料的主要优点是:____________和_____________。
19.(2002)铀主要以三种同位素的形式存在,三种同位素的原子百分含量分别是![]() 0.005%、
0.005%、![]() 0.72%、
0.72%、![]() 99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):
99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):
______ ______ ______ ____ __________________ ______ _____
20.(2002)在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式: ______ ______ ____ ________ ________
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物表面的反应的化学方程式:_____ ____ ________ ________
(3)新制的铜试剂[Cu(OH)2]与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:
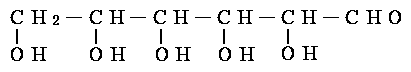 (简写为GCHO)
(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式:
______ ______ ______ ____ __________________ ______ _____
21.(2002)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃。)
高考综合科化学试题答案
一、单项选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | C | A | C | B | A | D | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | |||||
| 答案 | D | C | B | A | C |
二、填空题:
|
|
|
17、a CaCO3 == CaO + CO2 b C + O2 === CO2 c 2C8H18 +25O2 === 16CO2 + 18H2O
18、烃 碳的氧化物 氮的氧化物 2CH3OH + 3O2 → 2CO2 + 4H2O 无污染 可用水作原料,来源广泛。
19、(234×0.005 + 235×0.72 + 238×99.275)×10-2
20、 (1)CuSO4 + Fe = FeSO4 + Cu
|
(3)GCHO + 2Cu(OH)2 == GCOOH + Cu2O↓ + 2H2O
21、铜的化学性质比较稳定,不易被腐蚀;铜的熔点比较低,容易冶炼铸造成型。