高三第二轮复习理综化学模拟试卷(四)
第Ⅰ卷(选择题共48分)命题:陈日红
第Ⅰ卷
可能用到的相对原子质量:H:1 N:14 O:16 S:32 Cl:35.5 Fe:56 Cu:64
Pb:207 Cr:52
一.选择题(本题包括8小题,每小题6分,共48分。每小题只有一个选项符合题意)
6.下列有关环境、健康、发展的叙述中,不正确的是
A.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大
B.开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路
C.装修材料中的苯主要来自胶、漆等,是强致癌物
D.氟氯烃含量是空气质量报告的主要项目之一
7.2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
A.土卫六上存在有机分子 B.地表温度极高
C.地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统
8.下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+
B.澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4-
C.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Na+、Cl-、NO3-
D.含有较多的Al3+的溶液中:K+、Ca2+、ClO-、Cl-
9.如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为(
)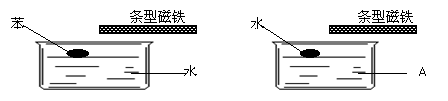
A.煤油 B. 酒精 C. 苯 D. 四氯化碳
10.陶瓷表面有一层绚丽多彩的彩釉,加工方法是在普通釉料中加入一些金属元素,控制烧制时空气的用量(即氧用量),使其得到不同的颜色。若空气不足,铁、铜、锰元素形成的化合物呈现的颜色分别是( )
A. 蓝或绿、红、黑褐 B. 红或黄、蓝、紫褐
C. 蓝或绿、蓝、黑褐 D. 红或黄、红、紫褐
 11、电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有N2和水生成。有关的说法中正确的是(
)
11、电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有N2和水生成。有关的说法中正确的是(
)
①水起着溶解NH4NO3,发生吸热现象以启动反应的发生的作用;②每还原1molNO3-需氧化1molNH4+和1molZn;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由NH4NO3反应放热而蒸出。
A、①② B、②③ C、③④ D、①④
![]()
![]()
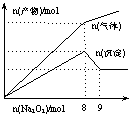
![]() 12.将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热5产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
12.将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热5产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol D.3 mol、2 mol、4 mol
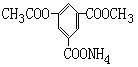 13. 某有机物结构简式如右图,
13. 某有机物结构简式如右图,
该物质1mol与足量NaOH溶液充分反应,
消耗NaOH的物质的量为( )
A. 6mol B. 5mol C. 4mol D. 3mol
第II卷(共60分)
姓名 班级 分数
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
26.(10分)已知:(I)苯的同系物能被酸性高锰酸钾氧化。例如:![]()
|
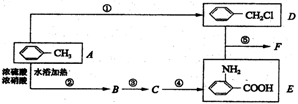
(Ⅲ)RNH2+R'CH2Cl———→RNHCH2R'+HCl (R和R'代表烃基)。据《中国制药》报道,化合物F是用于制备抗“非典”药品(盐酸祛炎痛)的中间产物,其合成路线如图。请按要求填空:
(1)C的结构简式是________________;B与E的关系为________________
(2)反应⑤的化学方程式为____________________________________________________。E在一定条件下,可聚合成热固性良好的功能高分子,有关反应的化学方程式为______________________________________
(3)反应①~⑤中,属于取代反应的是__________________
(4)若在化合物E的苯环上再引入一个-C2H3原子团形成化合物M,则1 mol M在以Ni为催化剂条件下加氢最多需H2________mol。
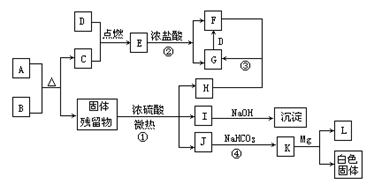 27.(9分)无色晶体A与黑色固体B可发生如下图所示的反应,除图中所示物质及反应条件外,其作反应物或生成物及反应条件均已略去.其中D、L为固态单质,C、H为气态单质.J的焰色反应为紫色.
27.(9分)无色晶体A与黑色固体B可发生如下图所示的反应,除图中所示物质及反应条件外,其作反应物或生成物及反应条件均已略去.其中D、L为固态单质,C、H为气态单质.J的焰色反应为紫色.
(1)写出化学式:A__________________,E__________________.
(2)写出物质K的电子式______________________.
(3)写出反应①②的化学方程式:
①____________________________________________________.
②____________________________________________________.
(4)写出反应③④的离子方程式:_______________________________________________________.
28.(19分)实验室中根据2SO2+O2≒2SO3,△H=-196.6KJ/mol设计如图所示实验装置来制备SO3固体。请回答下列问题:
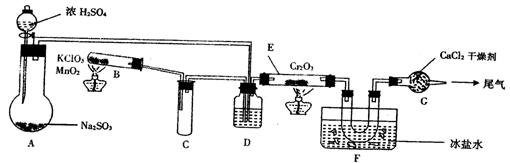
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程) 。
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是 。
(3)小试管C的作用是 。
(4)广口瓶D内盛的试剂是 。
装置D的三个作用是:① ;
② ;
③ 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是 。
(6)装置F中U型管内收集到的物质的颜色、状态是 。
(7)装置G的作用是 。
(8)从G装置导出的尾气处理方法是 。
26、(12分)在标准状况下将cmolCl2通入含amolFeBr2、bmolFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1) 将下表中空格填满:
| c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式 (只要求写盐类化合物) |
|
| FeBr2、FeI2、FeCl2 |
| b≤c<1/2(a+3b) |
|
|
| FeBr3、FeCl3 |
|
| FeCl3 |
(2)若a=b=1 、c=2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a=b=1 、c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应):_________________________________________________________.
高三第二轮复习理综化学模拟试卷(三)
答 案
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | B | D | D | A | B | C | B |
![]()
26、(10分)(1) ;互为同分异构体。
(2)
(3) ①②⑤。 (4) 4。
27. (1)KClO3,Fe3O4;
(2)
|
(3)①MnO2+2KCl+3H2SO4(浓)======2KHSO4+MnSO4+Cl2↑+2H2O
②Fe3O4+8HCl=====2FeCl3+FeCl2+4H2O
(4)③Cl2+2Fe2+====2Cl2++2Fe3+
④H++HCO3-====CO2↑+H2O
28.(19分) (1)检查装置的气密性
(2)水与浓硫酸作用放热,有利于SO2的放出
(3)缓冲、防止倒吸
(4)浓硫酸
①干燥SO2和O2
②使SO2和O2混合均匀 每空1分,其余每空2分
③通过观察控制气体比例和气流速度
(5)温度过高不利于SO3的生成,且影响催化剂的活性
(6)无色晶体或白色固体
(7)防止水蒸气与SO3接触
(8)用NaOH溶液吸收
①②③每空1分,其余每空2分。
29.(10分)
(1)(每空1分),
|
|
|
| 0<c<b |
|
|
| FeBr2 FeBr3 FeCl2 FeCl3 |
| 1/2(a+3b) ≤c<3/2(a+b) |
|
| c ≥ 3/2(a+b) |
|
(2)FeBr3、FeCl3 1:2 (每空2分)
(3)4Fe2+ + 4I- + 2Br- +5Cl2 ===4Fe3+ + 2I2 +Br2 + 10Cl-(2分)