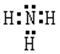高三第一次统一考试化学试题
可能用到的相对原子质量:H:1 N:14 O:16 Na:23 Mg:24 Al:27 Fe:56
Cu:64 Zn:65
第Ⅰ卷(选择题 共54分)
一、选择题(本题包括18小题,每小题只有一个选项符合题意。)
1.下列词汇中,其中所表述的颜色与相关物质的颜色并无密切联系的是 ( )
A.赤潮 B.绿色食品 C.白色塑料 D.黑烟
2.氮化硅(Si3N4)是一种新型的耐高温、耐磨材料,在工业上有广泛的用途,它属于( )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
3.为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找能源,以下做法不能提高燃料效率的是 ( )
A.煤的汽化与液化 B.液体燃料呈雾状喷出
C.通入大大过量的空气 D.将煤粉粉碎
4.根据化学方程式:S(s)+O2(g) SO2(g);△H =-
297.23kJ·mol-1,分析下列说法正确的是( )
A.S(g)+O2(g) SO2(g);△H=-297.23kJ·mol-1
B.S(g)+O2(g) SO2(g); △H>-297.23kJ·mol-1
C.SO2(g) S(g)+O2(g);
△H<+297.23kJ·mol-1
D.SO2(g) S(g)+O2(g);
△H>+297.23kJ·mol-1
5.不能证明酸HA是弱酸的是(常温下) ( )
A.NaA溶液的Ph=9
B.0.01mol·L-1HA溶液,其pH=4
C.pH=2的HA溶液稀释100倍后,其pH=3.5
D.HA溶液跟锌反应,放出H2很慢
6.将一小块金属钠投入过量的AlCl3溶液中,在所得的产物中没有 ( )
A.Al(OH)3 B.NaAlO2 C.NaCl D.H2
7.在一定条件下,RO3n—和氟气发生如下反应:RO3n—+F2+2OH— RO4—+2F—+H2O,从而可
知在RO3n—中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
8.某溶液中有NH4+、Fe2+、Ag+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中不会大量减少的离子是 ( )
A.NH4+ B.Fe2+ C.Ag+ D.Al3+
9.下列反应的离子方程式书写正确的是 ( )
|
2Cl-+2H2O Cl2↑+H2↑+2OH-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:
Ca2++2HCO3-+2OH- CO32-+CaCO3↓+2H2O
C.次氯酸钙溶液中通入过量的CO2:
Ca2++3ClO-+H2O+CO2 CaCO3↓+2HClO
D.氢氧化铁溶于碘化氢溶液:
Fe(OH)3+3H+ Fe3++3H2O
10.用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解氯化铜溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1
D.电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2
11.代表阿伏加德罗常数,下列说法正确的是 ( )
A.7.8gNa2O2与足量CO2反应,转移电子的个数为0.2NA
B.16gO2与16gO3所含有的氧原子数是NA
C.常温常压下,1moL水中含有NA个H+和NA个OH-
D.17克氨中共价键的数目为NA
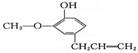 12.丁香油酚具有 的结构,该有机物不可能具有的性质是 ( )
12.丁香油酚具有 的结构,该有机物不可能具有的性质是 ( )
A.既可以燃烧,也可以使酸性KMnO4溶液褪色
B.可与NaHCO3溶液反应放出CO2气体
C.可与FeCl3溶液发生显色反应
D.可与溴水发生取代反应
13.短周期元素X、Y、Z在周期表中的位置关系如图所示,下列有关叙述正确的是( )
|
B.X的最高价氧化物的水化物是一种强酸
C.1mol单质Y跟足量水反应时,转移1mol电子
D.由Z单质形成的晶体属于分子晶体
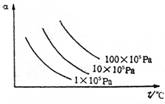
14右图纵坐标为反应物的转化率α,横坐标为温度(t℃),下列符合此图情况的反应是( )
|
![]() B.H2+Br2(g) 2HBr;△H<0
B.H2+Br2(g) 2HBr;△H<0
![]() C.N2+3H2 2NH3;△H<0
C.N2+3H2 2NH3;△H<0
![]() D.2SO3(g) 2SO2+O2;△H>0
D.2SO3(g) 2SO2+O2;△H>0
15.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着
pH的升高,沉淀增多,但当![]() 时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。
时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。
![]()
![]() 其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol/L的Cr2(SO4)3溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,
溶液中可观察到的现象为 ( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
16.HClO3是一种具有强氧化性的强酸,预计Cu和HClO3溶液反应的生成物不可能是( )
A.H2 B.Cl2 C.Cu(ClO3)2 D.CuCl2
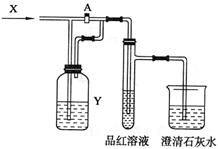 17.右图是一套检验气体性质的实验装置,向装置
17.右图是一套检验气体性质的实验装置,向装置
中缓慢通入气体X,若关闭活塞A,则品红溶
液无变化,而澄清石灰水变浑浊;若打开活塞
A,则品红溶液褪色。据此判断气体X和洗气
瓶内溶液Y分别可能是 ( )
| A | B | C | D | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和NaHCO3溶液 | 浓硫酸 | Na2SO3 | NaHSO3溶液 |
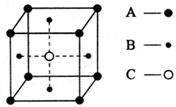 18.某物质的晶体中含有A、B、C三种元素,其排列
18.某物质的晶体中含有A、B、C三种元素,其排列
方式如图所示(其中前后两面面心中的B元素的
原子未能画出)。晶体中A、B、C的原子个数比
为 ( )
A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3
第Ⅰ卷选择题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
第Ⅱ卷(非选择题 共46分)
二、实验题(16分)
|
(1)此法的原理是
。
(2)某同学操作时,只做了①没有做②,他即认为装置的气密性良好。你认为他的结论是否正确? (答“是”或“否”)。理由是
。
20.(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。
现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍
高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。
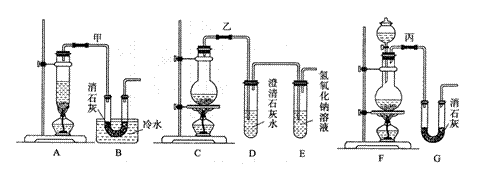 现有3个同学分别设计的3套实验装置如下图:
现有3个同学分别设计的3套实验装置如下图:
(1)写出制取氯气的化学方程式 。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的
选项的序号填在表中空格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副
反应发生;e.污染环境;f.可防止污染环境。
| 优 点 | 缺 点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分
连接顺序是 (按气流流动的方向)。该组合中还缺少的
装置是 ,原因是 。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过 mol。
三、填空题(共题共22分)
21.(4分)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼
和液态水,放出649.5kJ热量,该反应的热化学方程式为 。
已知:H2O(1) H2O(g),△H=44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成
气态小时放出的热量是 kJ。
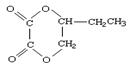
![]() 22.(8分)已知CH2
22.(8分)已知CH2 CH—CH CH2在不同条件下可与1molBr2发生反应,得到两种不同产物:
![]() ①CH2
①CH2 CH—CH CH2+Br2
CH2 CH—CH—CH2
![]() ②CH2
②CH2 CH—CH CH2+Br2
CH2—CH CH—CH2
![]() 又知炔和烯均可被酸性KMnO4氧化成羧酸:
又知炔和烯均可被酸性KMnO4氧化成羧酸:
![]() R—CH
R—CH CH—R′
R—COOH+R′—COOH
R—C≡C—R′ R—COOH+ R′—COOH
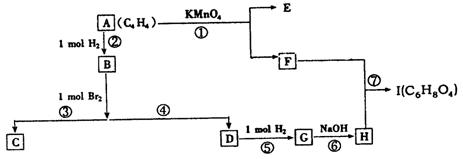
下图方格中每格均代表一种物质,从起始物A(C4H4,一种链烃)最终可得酯I(C6H8O4是具有六原子环的环状酯)。
|
(1)写出下列物质的结构简式:E ,I 。
(2)以上各反应中属于取代反应的有 (填序号)。
(3)反应⑥的化学方程式为 。
23.(10分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X
元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单
质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(注明反
应条件) ;E分子的空间构成型为 ,
电子式为 。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥,但长期施用会使土壤酸化,
有关的离子方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),
该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为 。
四.计算题
24.(8分)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol·L—1烧碱溶液至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | A | C | B | D | B | B | D | B | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| B | B | D | C | C | A | A | A |
19.(5分)(1)当手握住试管后,温度升高,气体体积膨胀,导管口有气泡:当手离开后,温度降低,气体体积缩小,大气压将水压入导管,导管内形成一段水柱。(2分)
(2)否。(1分)当手握住试管时,温度升高较快,即使有少量漏气,导管口也会有气泡:当手离开后,温度降低缓慢气体体积缩小的慢,空气会从漏气处进入试管,不会形成水柱,因此只做①不能证明不漏气。(2分)
20.(11分)(1)(1分)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)(6分)
| 优 点 | 缺 点 | |
| 甲装置 | d | a,e |
| 乙装置 | f | a,c |
| 丙装置 | b | c,e |
(3)(3分)F、B、E;还缺少除去氯气中的氯化氢杂质的装置;因为氯化氢可以与Ca(OH)2
和Ca(ClO) 2反应 (4)(1分)0.2
21.(4分)B2H6(g)+3O2(g) B2O3(s)+3H2O(1),△H=-2165kJ/mol;1016.5
22.(8分)(1)HCOOH(2分) (2分)
![]() (2)⑥⑦(2分)
(2)⑥⑦(2分)
|
|
 23.(10分)(1)(4分)H、C、N、O
23.(10分)(1)(4分)H、C、N、O
(2)(3分)N2+H2 2NH3;三角锥形;
![]() (3)(1分)NH4++H2O NH3·H2O+H+
(3)(1分)NH4++H2O NH3·H2O+H+
(4)(2分)NH4++HCO3-+2OH- NH3↑+2H2O+CO32-
24(8分)解:发生反应的离子方程式为 3Cu2++2Al 3Cu+2Al3+ ①
Al3++4OH— AlO2—+2H2O ② 2Al+2OH—+2H2O 2AlO2—+3H2↑ ③
由题可知n(H2)=![]()
则反应③消耗的n(NaOH)=0.0200mol n(Al)=0.0200mol
反应②消耗的n(NaOH)=2.00mol·L-1×0.210L-0.0200mol=0.400mol
则反应①消耗的n(Al)=0.100mol,n(Cu2+)=0.150mol
故加入铝粉的质量为 m(Al)=(0.100mol+0.0200mol)×27.0g·mol-1=3.24g
硫酸铜溶液的浓度为c(CuSO4)=![]()
(注:未使用有效数字扣1分,其它答案只要合理即可得分)