高三第一次形成性检测化学试卷
本试卷分为第Ⅰ卷和第Ⅱ卷两部分,满分100分,考试时间90分钟
第Ⅰ卷 (选择题 共60分)
一、选择题:(每小题3分,每题只有一个选项)
1.下列物质间的反应①Na+H2O;②Na2O+H2O;③NO2+H2O;④Cl2+H2O;⑤F2+H2O;⑥SO2+H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是 ( )
A.①③ B.②⑥ C.④⑤ D.③④
2.下列离子方程式正确的是 ( )
A.向氢氧化钠溶液中通入过量二氧化碳:2OH- + CO2 == CO32- + H2O
B.硫酸铵溶液中滴入氢氧化钡溶液:NH4+ + SO42-+Ba2+ + OH-== BaSO4↓+ NH3↑+ H2O
C.向偏铝酸钠溶液中通入少量CO2 :2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.溴化亚铁溶液中滴入过量新制的氯水:2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
3.对某酸性溶液(可能含有![]() ,
,![]() ,
,![]() ,
,![]() )分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入
)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入![]() 溶液,产生的白色沉淀不溶于稀硝酸.
溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4.向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的PH变化情况正确的是 ( )
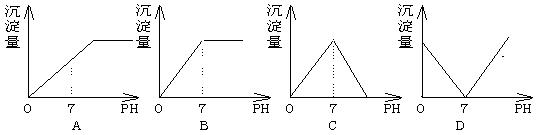
5.某胶体在电泳时,它的胶粒向阴极移动。在这种胶体中分别加入下列物质:①蔗糖溶液②硫酸镁溶液③硅酸溶胶④氢氧化铁胶体,不会发生聚沉的是( )
A.①③ B.①④ C.②③ D.③④
6.白磷易溶于![]() 形成溶液,磷元素在该溶液中存在的形式是 ( )
形成溶液,磷元素在该溶液中存在的形式是 ( )
A.![]() 分子
B.磷原子
分子
B.磷原子
C.![]() 分子 D.
分子 D.![]() 或
或![]() 分子
分子
7.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,
AG=![]() 。已知某无色溶液的AG=12,则在此溶液中能大量共存的离子
。已知某无色溶液的AG=12,则在此溶液中能大量共存的离子
组是 ( )
A.Na+、AlO2-、K+、NO3- B.MnO4-、K+、SO42-、Na+
C.Mg2+、SO42-、HCO3-、Na+ D.NH4+、NO3-、Al3+、Cl-
8.下列事实与胶体知识有关的是 ( )
①用盐卤点豆腐;②用明矾净水;③河海交接处易形成沙洲;④一束平行光照射蛋白质溶液时,从侧面可以看到光亮的通路;⑤三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀;⑥一支钢笔使用不同牌号的蓝黑墨水易出现堵塞;
A.①③④⑥ B.①②⑤④⑥ C.①②③④⑥ D.全部都有关
9.下列各组纯净物中,其分子内部都存在着极性共价键,其晶体为分子晶体的是 ( )
A.H2、NH3、SO3; B.CO2、CHCl3、C2H5OH;
C.NO、CaO、C12H22O11; D.P4、CS2、SiO2;
10.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为(已知还原性:I->Fe2+>Br->Cl-) ( )
A.7:1 B.7:2 C.7:3 D.7:4
11.将淀粉浆和淀粉酶的混合物放入半透膜袋中,扎好后浸入流动的温水中,经过足够长的时间后,取出袋内的液体,分别与①碘水;②新制Cu(OH)2加热;③浓硝酸(微热)作用,其现象依次是 ( )
A.显蓝色;无红色沉淀;显黄色 B.不显蓝色;无红色沉淀;显黄色
C.显蓝色;有红色沉淀;不显黄色 D.不显蓝色;有红色沉淀;不显黄色
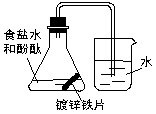 12.某课外活动小组,将剪下的一块镀锌铁片放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液, 按图装置进行实验,数分钟后观察,下列现象不可能出现的是
12.某课外活动小组,将剪下的一块镀锌铁片放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液, 按图装置进行实验,数分钟后观察,下列现象不可能出现的是
A. 烧杯中导气管口产生气泡;
B. 烧杯中导气管里形成一段水柱;
C.金属片剪口处变红;
D.锌被腐蚀;
13.在PCl3中加蒸馏水,微热,PCl3完全水解,产物之一是亚磷酸(H3PO3),其结构式为(如图)已知①H3PO3跟NaOH反应只能生成Na2HPO3和NaH2PO3两种盐。②盛H3PO3的试管中加AgNO3溶液有黑色沉淀Ag生成,试管口有红棕色气体出现。则下列有关叙述正确的是( )
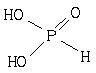 A.PCl3的水解反应为氧化还原反应
A.PCl3的水解反应为氧化还原反应
B.亚磷酸为三元酸
C. Na2HPO3和NaH2PO3均为酸式盐
D. D.亚磷酸为二元酸,且具有强还原性
14.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是 ( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
15.在酸性溶液中,用4×10-3mol的X2O72-离子,恰好将40mL0.6mol/LKI溶液中I—氧化为I2 单质,则元素X在还原产物中的化合价为 ( )
A.+1 B.+2 C.+3 D.+4
16.在下列各组溶液中加入甲基橙后显黄色,另加入酚酞后溶液呈无色,则溶液中一定能大量存在的离子组是 ( )
A.H+ 、Cl-、NH4+ B.S2-、CO32-、K+
C.SO42-、Na+ 、Cl- D.OH- 、AlO2-、K+
17.下列离子方程式不正确的是 ( )
![]() A.少量乙醛与银氨溶液混合水浴加热:
A.少量乙醛与银氨溶液混合水浴加热:
CH3CHO+2[Ag(NH3)]++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O
B.二氧化碳通入碳酸钠溶液中 CO2 + CO32- + H2O == 2HCO3-
C.硫酸铝溶液跟偏氯酸钠溶液反应Al3+ + 3AlO2- + 6H2O ==4Al(OH)3↓
D.氯气通入冷的氢氧化钠溶液中 2Cl2 + 2OH- == 3Cl-+ ClO- + H2O
18.下列反应中,硝酸既表现出酸性,又表现出氧化性的是 ( )
A.Fe(OH)3和稀HNO3 B.氧化亚铁和浓硝酸
C.碳与浓硝酸共热 D.BaCO3和硝酸
19.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示;现提供以下化学键的键能(KJ/mol):P—P 198、P—O 360、O=O 498则反应P4(白磷)+3O2=P4O6的反应热⊿H为 ( )
 A.—1638KJ/mol B.+1638KJ/mol
A.—1638KJ/mol B.+1638KJ/mol
C.—126KJ/mol D.+126KJ/mol
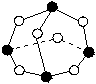
白磷 P4O6
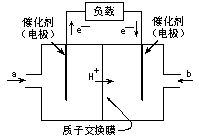
20.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2→2CO2+4H2O。下列说法正确的是 ( )
A.左电极为电池的负极,a处通入的物质是空气
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
D.正极反应式为:O2+4e-=2O2-
第Ⅱ卷 (非选择题 共40分)
二、(本题20分)
21.(6分)已知氧化性BrO3->ClO3->Cl2>IO3->I2 。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:① ;② 。
(2)有关的离子方程式:① ;② 。
22.(7分)PbO2是很强的氧化剂,在酸性溶液中它可将Mn2+氧化成MnO4-。取一支试管,加少量PbO2固体和2 mL的6mol·L-1H2SO4,然后再加2 mL的1mol·L-1MnSO4溶液,试回答:
⑴搅拌后,溶液的颜色变化是 。
⑵反应的离子方程式是 。(PbSO4是难溶物)
⑶能否用盐酸来代替硫酸 (填“能”或“不能” ),用离子方程式解释: 。
23.(7分)“神州五号”飞船使用液态四氧化二氮和液态偏二甲肼作推进剂。已知偏二甲肼由C、H、N三种元素组成,已知该化合物的相对分子质量为60,其中含碳40%,含氢13.3%,其余是氮。该分子中有一个氮原子不与H原子直接相连。燃料的氧化剂是液态N2O4,燃烧产物只有CO2、H2O(g)、N2;5.00g“偏二甲肼”完全燃烧可放出212.5kJ热量。
(1)“偏二甲肼”的分子式为 。
(2)写出“偏二甲肼”的结构简式 。
(3)写出燃料燃烧的热化学方程式: 。
三、(本题10分)
24.某澄清透明待测溶液中可能含有 :NH4+ 、 Mg2+ 、Al3+、 Fe2+ 、Cu2+、Br-、NO3-、SO42- 、SO32- 等离子中的一种或数种,进行下列实验:
根据实验结果:
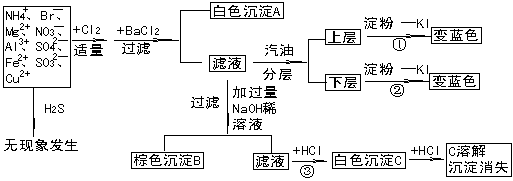
⑴判断待测液中有无SO32-离子,可能有的理由:
可能无的理由:
⑵写出沉淀B的成分:B中肯定含有 可能含有
⑶写出①、②、③各步反应的离子方程式:
① ②
③
四、(本题10分)
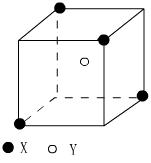 25.(5分)某离子晶体晶胞结构如右图所示,X 位于立方体的顶点,Y 位于立方体中心。试分析
25.(5分)某离子晶体晶胞结构如右图所示,X 位于立方体的顶点,Y 位于立方体中心。试分析
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX 的度数为 。 ( 填角的度数 )
26.(5分)盖斯定律可以简单地归纳为“如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。”已知在101KPa、25ºC时,1mol某烷烃完全燃烧生成CO2(g)和H2O(l),放出5518KJ的热量,并测得以下三个反应的反应热:①nC(s)+(n+1)H2(g)=CnH2n+2;ΔH= -202.2KJ/mol
②C(s)+O2(g)=CO2(g); ΔH= -393.5KJ/mol
③H2(g)
+ ![]() O2(g)=H2O(l); ΔH= -285.8KJ/mol;
O2(g)=H2O(l); ΔH= -285.8KJ/mol;
试计算CnH2n+2中的n值。
参考答案
一、选择题:(每小题3分, 共60分)
1.D 2.C 3.B 4.A 5.B 6.A 7.D 8.C 9.B 10.C
11.B 12.A 13.D 14.B 15.C 16.C 17.D 18.B 19.A 20.C
二、(本题20分)21.(6分)
(1)①先变蓝色;②后蓝色消失。
(2)①2I-+ Cl2=I2 +2Cl- ②I2+5Cl2+6 H2O=2 IO3-+10Cl-+12H+
22.(7分)⑴无色变为紫红色。
⑵ 2Mn2++5 PbO2+5 SO42-+4H+=2MnO4-+5PbSO4↓+2 H2O
⑶不能, PbO2+2 Cl-+4H+= Cl2↑+Pb2++2 H2O
23.(7分)(1)C2N2H8 (2)(CH3)2 N- NH2
(3)C2N2H8(l)+2 N2O4(l)=3 N2(g)+2 CO2(g)+4 H2O(l);△H=-2550kJ/mol
三、(本题10分)24、
⑴可能有的理由:SO32-被Cl2氧化成为SO42-,SO42-与Ba2+生成BaSO4沉淀;
可能无的理由:待测液中含有SO42-,SO42-与Ba2+生成BaSO4沉淀。
⑵B中肯定含有Fe(OH)3;可能含有Mg(OH)2
⑶①2I-+ Br2=I2 +2 Br- ②2I-+2 Fe3+ =I2 +2 Fe2+
③Al O2-+H++ H2O = Al(OH)3 ↓
四、(本题10分)25.(5分)
(1)4个,8个,XY2或Y2X (2)12个 (3)109°28′
26.(5分)n值为8(过程略)