高考化学考试题1
第I卷(共70分)
一、选择题(本题共30分),每小题2分,只有一个正确选项.
1.下列物质中,不含结晶水的是( ).
(A)芒硝 (B)大理石 (C)明矾 (D)生石膏
2.下列过程中,共价键被破坏的是( ).
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCl气体溶于水
3.下列电子式书写错误的是( ).
4.随着卤素原子半径的增大,下列递变规律正确的是( ).
(A)单质的熔沸点逐渐降低 (B)卤素离子的还原性逐渐增强
(C)气态氢化物稳定性逐渐增强 (D)单质氧化性逐渐增强
5.下列物质有固定元素组成的是( ).
(A)空气 (B)石蜡 (C)氨水 (D)二氧化氮气体
6.下列离子中最易给出电子的是( ).
(A)Cl- (B)Cu2+ (C)Fe2+ (D)F-
7.下列灭火剂能用于扑灭金属钠着火的是( ).
(A)干冰灭火剂 (B)黄砂
(C)干粉(含NaHCO3)灭火剂 (D)泡沫灭火剂
8.下列各组分子中,都属于含极性键的非极性分子的是( ).
(A)CO2 H2S (B)C2H4 CH4 (C)Cl2 C2H4 (D)NH3 HCl
9.对某一可逆反应来说,使用催化剂的作用是( ).
(A)提高反应物的平衡转化率
(B)以同样程度改变正逆反应的速度
(C)增大正反应速度,减小逆反应速度
(D)改变平衡混合物的组成
10.准确量取25.00毫升高锰酸钾溶液,可选用的仪器是( ).
(A)50ml量筒 (B)10ml量筒
(C)50ml酸式滴定管 (D)50ml碱式滴定管
11.下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是( ).
![]()
![]()
![]()
![]()
12.物质的量浓度相同的下列溶液中,含微粒种类最多的是( ).
(A)CaCl2 (B)CH3COONa (C)NH3 (D)K2S
13.下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可以鉴别的是( ).
(A)KOH和Al2(SO4)3 (B)稀H2SO4和NaHCO3
(C)CaCl2和Na2CO3 (D)Ba(OH)2和NaHSO4
14.检验氯化氢气体中是否混有Cl2,可采用的方法是( ).
(A)用干燥的蓝色石蕊试纸 (B)用干燥有色布条
(C)将气体通入硝酸银溶液 (D)用湿润的淀粉碘化钾试纸
15.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
(A)3摩/升HCl (B)4摩/升HNO3
(C)8摩/升NaOH (D)18摩升H2SO4
二、选择题(本题共24分),每小题3分,只有一个正确选项.
16.将下列物质分别加入溴水中,溴水颜色不变浅的是( ).
(A)KCl晶体 (B)H2S气体 (C)CCl4 (D)Mg
17.下列分离物质的方法中,根据微粒大小进行分离的是( ).
(A)萃取 (B)重结晶 (C)沉降 (D)渗析
18.将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是( ).
(A)溶液质量不变 (B)溶剂质量发生变化
(C)溶液为饱和溶液,浓度不变 (D)有晶体析出,溶剂质量不变
19.下列离子方程式书写正确的是( ).
(A)氯化铁溶液中通入硫化氢气体2Fe3++S2-=2Fe2++S↓
(B)碳酸钡中加入稀硫酸BaCO3+2H+=Ba2++CO2↑+H2O
(C)偏铝酸钠溶液中加入过量盐酸AlO2-+4H+=Al3++2H2O
(D)碳酸氢铵溶液中加入过量氢氧化钠溶液HCO3-+OH-=CO32-+H2O
20.0.1摩镁粉分别在足量的O2、CO2、N2中燃烧,生成固体的质量依次为W1、W2、W3.下列关系式正确的是( ).
(A)W2>W1>W3 (B)W1=W2>W3
(C)W1=W2=W3 (D)W3>W2>W1
21.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( ).
(A)NH4Cl (B)NH4HSO4 (C)CH3COONH4 (D)NH4HCO3
22.pH值为4的FeCl3溶液和pH值为10的K2CO3溶液中,水的电离度分别为α1和α2,则它们的大小关系是( ).
(A)α1>α2 (B)α1<α2 (C)α1=α2 (D)无法判断
23.m摩C2H2跟n摩H2在密闭容器中反应,当其达到平衡时,生成p摩C2H4.将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( ).
![]()
![]()
三、选择题(本题共16分).每小题4分,每小题有一个或两个正确选项.只有一个正确选项的,多选不给分.有两个正确选项的,选对一个给2分,选错一个该小题不给分.
![]() 24.在物质的量浓度均为0.01摩/升的CH3COOH和CH3COONa混合溶液中,测得[CH3COO-]>[Na+],则下列关系式正确的是( ).
24.在物质的量浓度均为0.01摩/升的CH3COOH和CH3COONa混合溶液中,测得[CH3COO-]>[Na+],则下列关系式正确的是( ).
(A)[H+]>[OH-] (B)[H+]<[OH-]
(C)[CH3COOH]>[CH3COO-] (D)[CH3COOH]+[CH3COO-]=0.02摩/升
25.某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( ).
(A)1:1 (B)1:2 (C)1:3 (D)1:4
26.将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20克,滤液质量比原石灰水减少5.8克.该有机物可能是( ).
(A)乙烯 (B)乙二醇 (C)乙醇 (D)甲酸甲酯
27.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是( ).
(A)肯定有KNO3
(B)肯定有KNO3,可能还含有Na2CO3
(C)肯定没有Ba(NO3)2,可能有KNO3
(D)肯定没有Na2CO3和Ba(NO3)2
第Ⅱ卷(共80分)
四、(本题共24分)
28.(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
反应中 元素被还原.
![]() (2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为
(2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为
强弱为:Cl-<Br-<CN-<SCN-<I-.试写出:
①(CN)2与KOH溶液反应的化学方程式
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式
29.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子排布式为nsnnp2n.C、D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的营养元素之一.
试写出:
(1)A、B元素形成的酸酐的化学式 ;
(2)D元素的单质与水反应的化学方程式 ;
(3)A、C元素气态氢化物的稳定性大小 < (用分子式表示).
考生注意:30、31题为分叉题,各分A、B两题,考生可任选一题,如A、B两题都做,只以A题计分.
30.(A)将等物质的量的A、B、C、D四种物质混合,发生如下反应:
![]()
![]()
![]() aA+bB cC(固)+dD
aA+bB cC(固)+dD
![]()
![]()
(1)该化学方程式中各物质的系数为:a= 、b= 、c= 、d= ;
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A 、B 、D ;
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为 反应(填"放热"或"吸热").
30.(B)下列反应在210℃达到平衡:
PCl5(气) PCl3(气)+Cl2(气)-Q1 K=1 ①
![]() CO(气)+Cl2(气) COCl2(气)+Q2 K=5x104 ②
CO(气)+Cl2(气) COCl2(气)+Q2 K=5x104 ②
COCl2(气) CO(气)+Cl2(气)-Q2 ③
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
(a)[PCl5]=[PCl3]=[Cl2]=1
(b)[PCl5]=[PCl3][Cl2]=1
(c)[PCl5]=[PCl3][Cl2]
反应②和反应③的平衡常数K表达式 (填"相同"或"不同");
(2)降低Cl2浓度,反应③的K值 (填"增大"、"减小"或"不变");
(3)要使反应①和反应②的K值相等,应采取的措施是 .
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c)反应①降低温度,反应②维持在210℃
31.(A)化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1摩NH3,可生成2摩H2,组成化合物E的元素是 和 ;
(3)1摩E和2摩NH3恰好完全反应,化合物E的分子式为 .
31.(B)(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关"固硫"(不使硫化合物进入大气)反应的化学方程式:
,
![]() (2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨).NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:
.
(2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨).NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:
.
五、(本题共22分)
32.实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
![]()
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量(mCuo、
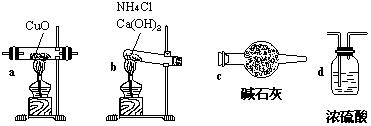 |
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;
d中浓硫酸的作用是 , ;
实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 .(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮
(c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有
![]()
![]()
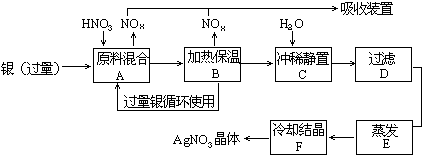 |
33.某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀).原因是 .
(a)减少过程中产生NOx的量
(b)减少原料银的消耗量
(c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速度
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C是为了除去Fe3+、Cu2+等杂质.冲稀静置时发生的化学反应是 ;
(a)置换反应 (b)水解反应 (c)氧化—还原反应
产生的沉淀物化学式: .
六、(本题共18分)
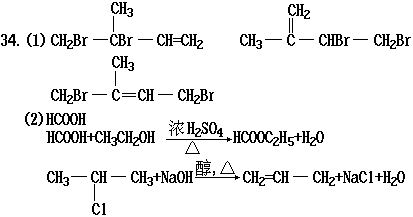
的结构简式:
(2)现有下列A、B两组物质:
A组:CH3-CHCl-CH3、、HCOOH、CH3COOC2H5
B组:CH3CH2OH、银氨溶液、NaOH水溶液、NaOH醇溶液
试回答:A组中 能跟B组中所有物质在一定条件下发生反应,其中属于酯化反应的化学方程式为 ;
B组中某物质跟A组中某物质发生消去反应的化学方程式为 .
35.有机物A、B、C中碳、氢、氧三元素物质的量之比均为1:2:1,它们都能发生银镜反应,但都不能发生水解反应.B1、B2是B的同分异构体.又知:
B2为无色液体,也能发生银镜反应;
1摩C完全燃烧需要3摩氧气.
试回答:(1)B2的名称 ,A、B的结构简式:A 、B ;
(2)写出X→Y的化学方程式: ;
(3)C的结构简式 ,与C互为同分异构体,且属于乙酸酯类化合物的结构简式 , .
七、(本题共16分)
36.六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH)3沉淀.其主要反应的化学方程式如下:
H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O
现用上法处理1×104升含铬(+6价)78毫克/升的废水(Cr相对原子质量52),试回答:
(1)处理后,沉淀物中除Cr(OH)3外,还有 、 (用化学式表示).
(2)需用绿矾多少千克?
37.现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应.设Al3+物质的量与总物质的量的比值为x.
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围.
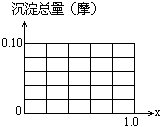 |
请在下图中画出沉淀总量(摩)随x(0→1)变化的曲线.
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示).
1996上海 参考答案
第Ⅰ卷
一、1.B 2.D 3.A 4.B 5.D
6.C 7.B 8.B 9.B 10.C
11.C 12.D 13.A 14.D 15.A
二、16.A 17.D 18.B 19.C 20.A
21.B 22.C 23.D
三、24.A、D 25.B 26.B、C 27.A、B
第Ⅱ卷
四、
28.(1)2 4 4 2 1 (说明:错一个即不给分)Mn(或锰)
(2)(CN)2+2KON=KCN+KCNO+H2O 2SCN-+(CN)2=2CN-+(SCN)2
29.(1)N2O3或N2O5(2)2Li+2H2O=2LiOH+H2↑(3)PH3<NH3
30.(A)(1)2 1 3 2(说明:错一个就不给分)
(2)气 固或液 气 (3)放热
(B)(1)c 不同 (2)不变 (3)a
31.(A)(1)B3N3H6 (2)硼(或B) 氢(或H) (3)B2H6
(B)CaO+SO2=CaSO3(2分), 2CaSO3+O2=2CaSO4(1分)
加液氨后,使HClO部分转化为较稳定的NH2Cl.当CHlO开始消耗后,上述化学平衡向左移动,又产生HClO起杀菌作用.
五、
32.(1)①b c a c d 吸收未反应的氨 防止空气中水分进入 固体由黑色转变![]()
(2)a、c
33.(1)稀a、c (2)a、c (3)b Fe(OH)3Cu(OH)2
 六、
六、
![]() 35.
35.
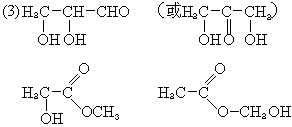 |
七、
36.(1)Fe(OH)3 CaSO4
![]()
![]()
=12510(克)=12.51(千克)
37.(1)按反应Fe3+ + 3OH- = Fe(OH)3↓
0.1-0.4×0.1 3×0.06
=0.06摩 =0.18摩 0.06摩
Al3+ + 4OH- = AlO2-+2H2O
0.4×0.1 4×0.04
![]()
∴有0.06摩Fe(OH)3沉淀
![]()
x的最大取值为 0.1(1-x)×3+0.4x=0.09×4,x=0.6
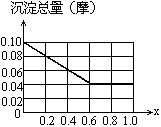 ∴在0≤x≤0.6时,沉淀只有Fe(OH)3
∴在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0时,Fe(OH)3沉淀量为0.1摩,
x=0.4时,Fe(OH)3沉淀量为0.06摩,
x=0.6时,Fe(OH)3沉淀量为0.04摩,
在0.6≤x≤1内,总沉淀量:
n总=0.1(1-x)+0.1x=0.04摩
![]()
![]()
![]()
![]()