|
|
高考化学模拟考试
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共150分。考试时间120分钟(7 :35 ~ 9 :35)。
![]() 可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
S—32 Cl—35.5 Ca—40 Zn—65 Fe—56 Ag—108 Ba—137
K—39 Cu—64 F—19 Br—80 I—127 P—31 Si—28 Mn—55
第I卷 选择题(共68分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有一个正确选项)
1.我国科学家在世界上首次发现铂的一新同位素![]() Pt,下列说法正确的是 ( D )
Pt,下列说法正确的是 ( D )
A.![]() Pt 的相对原子质量为202 B.
Pt 的相对原子质量为202 B.![]() Pt 的原子质量为202
Pt 的原子质量为202
C.铂元素的质量数为202 D.![]() Pt的原子核内有124个中子
Pt的原子核内有124个中子
2.下列物质呈固态时必为分子晶体的是 ( C )
A.非金属氧化物 B.非金属单质 C.含氧酸 D. 金属氧化物
3.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是 ( B )
A.KMnO4 B.NaClO C.H2O2 D.Cl2
4.下列事实与氢键有关的是 ( B )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.在某未知溶液中再溶解一定量的CH3COONa晶体,测得c(Na+)与c(CH3COO-)几乎相等,则原未知溶液可能是 ( D )
A.HCl溶液 B.NaOH溶液 C.KCl溶液 D.KOH溶液
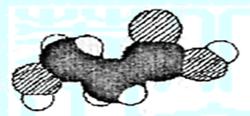 6.下图是某有机物分子的比例模型,有关该
6.下图是某有机物分子的比例模型,有关该
物质的推断不正确的是( C )
A.分子中可能含有羟基
B.分子中可能含有羧基
C.分子中可能含有氨基
D.该物质的分子式可能为C3H6O3
7.1,5一戊二醛(简称GA),是一种重要的饱和直链二元醛。2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用。根据上述信息,判断下列说法中正确的是 ( A )
A.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用
B.戊二醛不能在加热条件下和新制备的氢氧化铜反应
C.戊二醛不能使酸性KMnO4溶液褪色
D.戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种
8.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是 ( D )
A. 生成物的质量分数一定增加 B. 反应物的转化率一定增大
C. 正反应速率一定增大 D. 正反应速率一定大于逆反应速率
二、选择题(本题包括11小题,每题4分,共44分。每小题有1~2个正确选项。若正确答案包括两个选项,只选一个且正确2分,选两个且都正确4分;但只要选错一个,该小题 0分)
9. 下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是
( D )
A.Ca2+、Fe2+、NO3-、Cl- B.K+、Mg2+、HCO3-、PO43-
C.Na+、K+、SO42-、SO32- D.Ba2+、Na+ 、I-、NO3-
![]() 10.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH — 2CO32— + 6H2O,则下列说法错误的是 ( A )
10.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH — 2CO32— + 6H2O,则下列说法错误的是 ( A )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
11. 由一种阳离子与两种酸根离子组成的盐称为混盐,混盐CaOCl2在酸性条件下可以产生氯气,下列关于混盐CaOCl2的有关判断,不正确的是 ( CD )
A.该混盐具有较强的氧化性
B.该混盐中氯元素的化合价为+1价和—1价
C.该混盐与硫酸反应产生1mol Cl2时转移2NA个电子
D.该混盐的水溶液显酸性
12. 有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为 ( D )
A.89.6mL B.112mL C.168mL D.224mL
13. 法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( C )
A、该粒子不显电性; B、该粒子质量数为4;
C、在周期表中与氢元素占同一位置; D、该粒子质量比氢原子大 ;
14. PH=3的二元弱酸![]() R溶液与V升pH=11的NaOH溶液混合后,混合液的pH=7.下列判断正确的是
( B )
R溶液与V升pH=11的NaOH溶液混合后,混合液的pH=7.下列判断正确的是
( B )
A.溶液总体积为2V升
B.溶液中2c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )
)
C.溶液中c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.溶液中c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )=c(
)=c(![]() )
)
15. 25℃时,将两铜电极插入一定量的硫酸铜饱和溶液中进行电解,通电一段时间后,阴极析出了a mol气体,同时有W gNa2SO4•10H2O晶体析出,温度不变时剩余溶液中溶质的质量分数为 ( C )
A、![]() ×100%
B、
×100%
B、![]() ×100%
×100%
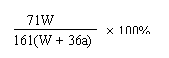 | |||
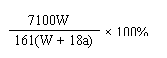 | |||
C、 D、
16. 在一定条件下,RO3—与R—发生如下反应:RO3—+5R—+6H+ ===3R2+3H2O,下列关于R元素的叙述正确的是 ( AB )
A、R位于VIIA族
B、R的氢化物的水溶液属于强酸
C、RO3—中的R只能被还原
D、R2在常温常压下一定是气体
17.下列离子方程式中正确的是 ( C )
A、 向明矾溶液中加入Ba(OH)2溶液至Al3+刚好完全沉淀:
Al3+ + SO42— + 3OH— + Ba2+ === BaSO4↓ + Al(OH)3↓
B、 氟气和水反应
2F2 + 2H2O === 4H+ + 4F— + O2
C、 向澄清石灰水中加入少量小苏打溶液
Ca2+ + OH— + HCO3— === CaCO3↓+ H2O
D、铜片投入稀HNO3溶液
Cu + NO3— + 4H+ === NO↑+ 2H2O + Cu2+
18. 可逆反应aA(s)+bB(g) ![]() cC(g)+dD(g) ;ΔH=Q反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图
cC(g)+dD(g) ;ΔH=Q反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图
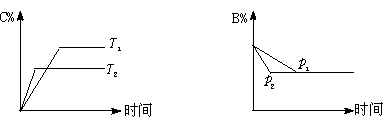
据图分析,以下正确的是 ( BD )
A.T1>T2 ,Q>0 B.T1<T2 ,Q<0 C.p1>p2,a+b =c+d D.p1<p2 ,b = c+d
19. 下列各组物质用一种试剂不能加以鉴别的是 ( A )
A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液
B.苯、苯酚溶液、己烯和乙醇
C.Na2SO4溶液、Na2SO3溶液、Na2CO3溶液、NaAlO2溶液
D.NaCl溶液、NH4Cl溶液、(NH4)2SO4溶液、Na2SO4溶液

 高
考 模 拟 考 试
高
考 模 拟 考 试
化 学
( 第I卷答题表格 )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
第II卷 (非选择题 共82分)
三、(本题有2小题,共22分)
20.(8分)(1)硫酸铜晶体结晶水含量测定的实验,包括研磨、加热、称量等操作步骤。其中判断硫酸铜晶体完全失水的定性实验现象是_________ ______________ ___ ____,完成测定过程至少要进行 次称量操作。
(2)比较分析是化学学习中重要的学习方法,也是我们学习中解决问题的重要思想。某同学在进行镁铝性质实验时,发现用铝分别与H+浓度相同的稀硫酸和稀盐酸反应时,实验现象明显不同,在铝与硫酸的反应中,产生的气泡很少。从反应本质看,两者的实验现象应该相同。在不考虑实验条件、操作和药品纯度的情况下,请你对上述实验现象提出假设,并设计一简单的实验来验证你的假设。你的假设是
,实验操作和现象是
。
21.(14分) 某研究性学习小组的同学对绿矾受热分解的情况进行探究。
(1)资料表明,在加热条件下三氧化硫具有比较强的氧化性。甲同学认为,绿矾受热分解的产物是FeO、SO3、H2O。你支持甲同学的观点吗?说明你的理由 ;
(2)实验是解决问题的重要手段。乙同学用如下装置通过实验来探究绿矾受热分解的产物情况(加热及夹持装置未画出):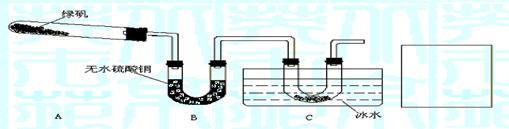 实验过程中发现:装置A中有残留固体,装置B中无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现。
实验过程中发现:装置A中有残留固体,装置B中无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现。
回答下列问题:
① 在装置C导管出口处还应有的实验现象是
;
②装置A中残留的固体是 ;装置C中的U形管中无色晶体是 ;
③乙同学为了验证绿矾受热分解的所有产物,在C装置后连接了一个装置,并选用了合适的药品不仅达到了实验目的而且还起到了一举两得的效果。请你在C装置后的方框中画出该装置,并注明选用的药品。
④写出绿矾受热分解的化学方程式 。
四、(本大题有2小题,共22分)
22.(10分)下图中A~J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
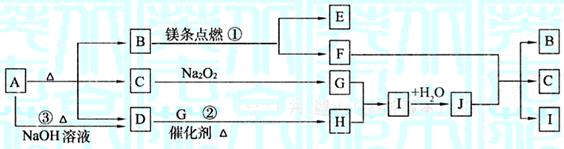
请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:
① ;
② 。
(3)反应③的离子方程式为: 。
23.(12分)下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
用化学式号填写下列空格:
(1)A是__________。(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是_______ ___。
(4)B跟Cl2反应的化学方程式是_______________ ______ ___________________。
五、(本大题有2小题,共18分)
24.(8分)某烃的含氧衍生物A的相对分子质量为240,其碳的质量分数为80.0%,氧的质量分数是氢的质量分数的2倍,分子中含有2个苯环,每个苯环上都只有一个取代基,该取代基无支链。A在稀酸溶液中加热时发生水解,得到B和C,C的相对分子质量为108。请写出:
(1)A的分子式 。
(2)C的结构简式 。
(3) B和结构简式 。
25.(10分)已知羧酸在磷的催化条件下可以和卤麦反应生成α-卤代物(与羟基相邻的碳原子上的氢原子被取代):
P
![]() RCH2COOH+Cl2
RCHCOOH+HCl
RCH2COOH+Cl2
RCHCOOH+HCl
Cl
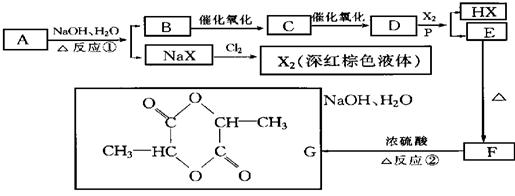
(1)写出有机物A、C、D的结构简式:
A. ,C. ,D. 。
(2)写出下列反应的化学方程式:
反应①: 。
反应② 。
 六、(本大题2小题,共20分)
六、(本大题2小题,共20分)
26.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.4mL与2.00mol/L的氢氧化钠溶
液100mL混合,再将混合后溶液稀释至1.00L,
此时溶液的pH约为多少?
27.(12分)中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
 |
①写出n(OH-)、n(Ca2+)和n(Na+)的关系:n(Na+)=________________________。
②设n(Na+)=xmol、n(Ca2+)=ymol,请填写下表:
| 碱右灰的 可能组成 | NaOH、CaO | NaOH、CaO、Ca(OH)2 | NaOH、Ca(OH)2 | NaOH、Ca(OH)2、H2O |
| n(Na+)和n(Ca2+) 的关系 | 40x+56y=0.4 |
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g。请通过计算确定该碱石灰各成分的质量分数。
高 考 模 拟 考 试
| |
一、二
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | B | B | D | C | A | D | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
| 答案 | CD | D | C | B | C | AB | C | BD | A |
|
三、(本题有2小题,共22分)
20.(8分)(1)蓝色硫酸铜晶体完全变成白色粉末 4
(2)硫酸根离子对铝与氢离子的反应有抑制作用等 在铝与盐酸的反应溶液中,加入Na2SO4固体,观察反应速率是否减慢(其他合理答案同样给分) (各 2分)
21.(14分)(1)不支持 FeO有还原性,SO3有氧化性,受热时要发生氧化还原反应(3分)
(2)①在C装置的导管出口处有刺激性气味 (2分)
|
③
(3分)(其他合理答案同样给分)
④2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O(2分)
Fe2O3+SO2↑+SO3↑+14H2O(2分)
四、(本大题有2小题,共22分)
22.(10分)(每空2分,共10分)(1) ![]() 三角锥形
三角锥形
| |||
| |||
(2)2Mg+CO2 2MgO+C; 4NH3+5O2
4NO+6H2O
|
(3)NH4++HCO3-+2OH-+2OH NH3↑+CO![]() +2H2O
+2H2O
23、(12分)分析:正盐A能与强酸反应生成气态氢化物,则A中含无氧酸根即非金属阴离子。该非金属单质可被O2连续两次氧化,分别生成两种氧化物,故A中含S2-。其转化过程是:
S2-![]() H2S
H2S![]() S
S![]() SO2
SO2![]() SO3
SO3![]() H2SO4。
H2SO4。
又因为正盐A能与强碱反应生成气态氢化物,则A中含NH4+。气态氢化物NH3中氮被Cl2置换后生成的HCl又与NH3化合成NH4Cl。其转化过程是:
![]() NH4+
NH4+![]() NH3
NH3![]() N2
N2![]() NO
NO![]() NO2
NO2![]() HNO3。
HNO3。
答案:(1)(NH4)2S;(2)H2SO4 ;(3)HNO3;(4)H2S+Cl2=2HCl+S↓, 8NH3+3Cl2=N2+6NH4Cl
五、(本大题有2小题,共18分)
24.(8分)(1)C16H16O2 (2)
|
25.(10分)(每空2分,共10分)(1)CH3CH2CH2Br;CH3CH2CH2OH;CH3CH2CHO
![]() (2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
(2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
![]() (或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
(或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
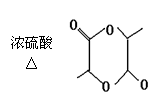 |
![]() 2CH3CH2COOH +2H2O
2CH3CH2COOH +2H2O
OH
六、(本大题2小题,共20分)
26.(8分)(1)c(HCl)=1000×1.18×36.5%÷36.5 =11.8mol·L-1(3分)
(2)n(HCl)=11.8×0.0254=0.300mol
n(NaOH)=2.00×0.01=0.200mol (3分)
pH=1g(0.300-0.200)/1=1 (2分)
27、(12分)(1)①n(OH-)—2n(Ca2+) (2分)
②40x+56y<0.4<40x+74y (2分) 40x+74y=0.4 (2分)
40x+74y <0.4 (2分)
(2)w[Ca(OH)2]=72%(2分) W(NaOH)=13% W(H2O)=15%(2分)