高考化学模拟试题3
第Ⅰ卷(选择题 共72分)
一、选择题(每小题只有一个正确答案,每小题4分,共32分)
1..在泡沫橡胶制造过程中,利用反应2H2O2=2H2O+O2↑其中H2O2的作用是( )
A.仅为氧化剂
B.仅为还原剂
C.既作氧化剂,又作还原剂
D.既不作氧化剂,也不作还原剂
2.“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济设计可行的化学反应,尽可能减少对环境的负作用,下列化学反应符合绿色化学概念的是( )
A.制CuSO4:Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2====2CuO,CuO+H2SO4(稀)====CuSO4+H2O
C.制Cu(NO3)2:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
3. X、Y为短周期元素,X原子所具有的电子层数是最外层电子数的![]() ,Y原子次外层电子数是最外层电子数的
,Y原子次外层电子数是最外层电子数的![]() ,X与Y能形成多种原子团,其中一定不存在的是( )
,X与Y能形成多种原子团,其中一定不存在的是( )
A.X2Y![]() B.XY
B.XY![]() C.XY
C.XY![]() D.X2Y
D.X2Y![]()
4、某温度下,在体积一定的密闭容器中适量的 NH3(g) 和 Cl2(g) 恰好完全反应。若反应产物只有 N2(g) 和 NH4Cl(s),则反应前后容器中压强比应接近于( )
A.1∶11 B.11∶1 C.7∶1 D.11∶7
5、某共价化合物C、H、N三种元素,其分子内有4个氮原子,且4个单原子排列成内空的四面体,如同白磷的分子结构,每两个氮原子见都有一个碳原子,已知此分子内碳原子与碳原子之间不直接形成化学键,则该化合物的分子式为:( )
A、CH4N4 B、C6H12N4 C、C6H10N4 D、C4H8N4
6、航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物作固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4![]() N2↑+4H2O+Cl2↑+2O2↑+Q,下列对此反应的叙述中错误的是( )
N2↑+4H2O+Cl2↑+2O2↑+Q,下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
7、将13.2克可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH反应,可收集到4.3升NH3(密度为17克/22.4升),则样品中不可能含有的物质是( )
A. NH4HCO3、NH4NO3 B.
(NH4)2CO3、NH4NO3
C. NH4HCO3、NH4Cl D. NH4Cl、(NH4)2CO3
8、Na3N是离子化合物,它与水反应可生成NH3,下列说法不正确的是( )
A、Na3N与过量盐酸反应可生成两种盐
B、Na3N与水的反应中,Na3N作还原剂
C、Na+与N3-离子的电子层结构均与氖原子相同
D、Na3N与水反应后所得溶液呈碱性
二、选择题(每小题有1~2个正确答案,每小题4分,共40分)
9、 等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是( )
A、[M+]>[OH-]>[A-]>[H+] B、[M+]>[A-]>[H+]>[OH-]
C、[M+]>[A-]>[OH-]>[H+] D、[M+]>[H+] =[OH-]+[A-]
10、电石气中常含有无色有大蒜臭味的有毒气体膦(PH3),它的分子为三角锥形。以下关于PH3的叙述正确的是( )
A PH3分子中的化学键为非极性键 B PH3是非极性分子
C PH3的热稳定性不如NH3 D PH3不可在空气中燃烧
11.下列溶液中,pH>8的是( )
A 将0.1mol/L氨水跟0.1mol/L盐酸等体积混合后的溶液
B 将pH=12的NaOH溶液稀释至100倍后所得到的溶液
C 将pH=5的醋酸溶液稀释至10000倍后所得到的溶液
D 将[OH-]=10-6mol/L的NaOH溶液10mL加入浓度为10-5mol/L的NaOH溶液100mL后的溶液
12.六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。下式中能表示六氯苯的是( )
A 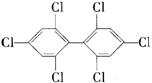 B
B 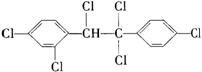
C 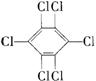 D
D 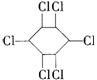
13.20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是( )
A 氧元素的一种同位素 B 臭氧的同素异形体
C 一种新的氧化物 D 可能是非极性键构成的非极性分子
14.如下图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为( )
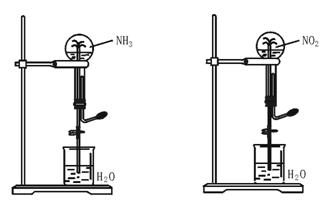 |
A.①>② B.①<② C.①=② D.不能确定
15、制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D.烧杯中铁、铜都无
16、Muard等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理不奖,关于NO的下列叙述不正确的是( )
A、NO可以是某些含低价N物质氧化的产物 B、NO是亚硝酸的酸酐
C、NO可以是某些含高价N物质还原的产物 D、NO是红棕色气体
17.下列离子方程式书写正确的是( )
A 碳酸氢钙溶液中加入过量的氢氧化钠溶液:
HCO3-+OH-=CO32-+H2O
B 氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C 次氯酸钙溶液中通人过量二氧化碳:
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D 氯化亚铁溶液中加入硝酸:
3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
18、已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电![]() 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示:
![]()
![]() 据此判断下列叙述中正确的是( )
据此判断下列叙述中正确的是( )
A、放电时负极电极反应式为:
![]() B、充电时阴极电极反应式为:
B、充电时阴极电极反应式为:
C、充电时,若要使1mol PbSO4 转变为Pb和PbO2,则需要通过2mol电子
D、放电时,H+向负极移动
第Ⅱ卷(非选择题共78分)
三、(本题共2小题,20分)
19. (8分)在热的稀硫酸中溶解了22.8 g硫酸亚铁,当加入100 mL 0.50 mol·L-1硝酸钾溶液时,其中的亚铁离子完全转化为铁离子,并有氮氧化物逸出:
____FeSO4+___KNO3+ _____![]() ___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O
___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O
(1)配平该化学方程式(将含a、b的计量数和所缺物质填在横线上)
(2)反应中起氧化作用的物质是________(写化学式)
(3)推算出a、b的数值:a=________,b=________。
20、(12分)为了进行I项实验,请从II项中选出一种试剂,从Ⅲ项中选出一种合适的实验操作方法,将标号填在后面的答案栏内。
| I实验 | II试剂 | Ⅲ操作方法 | 答案 | ||
| I | II | Ⅲ | |||
| ①除去苯中的苯酚 | A、溴水 B、水 C、氢氧化钠溶液 D、氧化钙 E、碳酸钠溶液 | a、蒸馏 b、过滤 c、洗气 d、分液 e、渗析 | ① | ||
| ②除去工业酒精中的水 | ② | ||||
| ③除去乙酸乙酯中的乙酸 | ③ | ||||
| ④除去溴乙烷中的乙醇 | ④ | ||||
| ⑤除去甲烷中的乙烯 | ⑤ | ||||
写出①和③中发生反应的化学方程式:
_____________________________________________________________
___________________________________________________________________
四、(本题共2小题,20分)
21、(12分)利用下列装置进行实验,可证明碳和浓硫酸反应放出的气体。已知左图中4个洗气瓶均装有检测液,现给出4种溶液:①酸性高锰酸钾溶液;②品红溶液;③澄清石灰水;④浓硫酸。
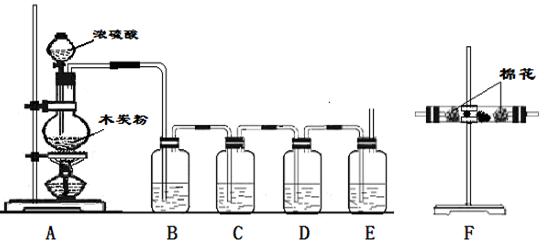 (1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(2)试指出B、C、D、E各洗气瓶所盛液体的名称和作用。
B.__________________,______________________________________
C.__________________,_____________________________________
D.__________________,_____________________________________
E.__________________,______________________________________。
(3)上述装置只能证明木炭粉和浓硫酸反应生成的部分气体,为了验证生成的另一种物质可在_____________装置之间连接F装置,F装置所盛有的试剂是____________,其现象是________________________。
22、(8分)A→F均为中学化学中常见的物质,它们之间相互转化的关系如下:
(1)写出下列物质的化学式:A_________;D___________;F__________.
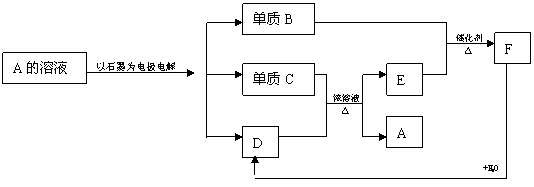 |
(2)C与D的稀溶液不反应,但若加入B在加热条件下可以反应生成A,试写该反应的化学方程式:________________________________________.
 六、(本题共2小题,18分)
六、(本题共2小题,18分)
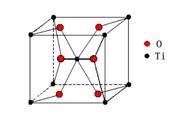
23、(8分)金属钛由于在许多方面的优良性能,正日益广泛地应用于空间技术、航海、化工和医疗等诸多领域,钛在自然界中存在的一种矿物叫金红石,金红石的晶体结构如右图所示。
(1)按金红石的晶体结构示意图可推知金红石的组成为____________________.
(2)钛在地壳中广泛分布,占地壳质量的0.42%,在所有元素中居第九位,比碳、锰、铜、锌都要多,但由于提取上的困难,直至1790年才被发现,因此可知:钛是__________.
A、较稳定的金属 B、较活泼的金属
C、资源丰富,但极为分散 D、在地壳了储量较少,容易制取单质
(3)钛及钛合金具有极强的抗腐蚀能力,浸于海水中的钛,十年无锈斑,因此被用于制造轮船、潜艇和重要的化工设备,钛的这一性质是由于在表面形成致密的氧化物保护膜而使金属钛___________.
(4)TiO2是极稳定的化合物,冶铁金属钛的中间产物TiCl4会因水解而生成TiO2,其水解反应的化学方程式可写成____________________________________.
(5)钛被称为“生物金属”,用于医疗上接骨和制造人工关节,新的骨骼和肌肉可以在钛的表面生长,所以钛是比不锈钢性能优良的生物医学功能材料。因此可推测金属钛在生物医学上这些用途是因为钛具有____________的性质。
A、 钛的密度与人体骨骼密度接近
B、钛的抗腐蚀性能好,不被人的体液腐蚀
C、金属钛的来源广泛,价格便宜
D、金属钛的储量丰富,冶炼容易
(6)钛被为“航天金属”,被广泛用于制造航空航天飞行器的结构材料,下列说法中正确的是_____________.
A、 钛的密度比铁、铝的密度都小
B、 钛有很高的熔点,不易被熔化
C、 钛有很高的熔点,不易被熔化
D、 钛比铁、铝的来源广泛,更易获得
(7)金属钛的冶炼主要分为两点:①在高温环境下,将TiO2在有炭粉存在的条件下用Cl2处理,在高温下得到TiCl4;②用镁(或钠)在高温下和氩气存在的气氛中还原TiCl4而制得金属钛,上述两步反应的化学方程式:
①____________________________________________________,
②____________________________________________________.
24.(10分)2,5—联苯二甲酸(PTA)是一个重要的高分子合成单体。PTA的合成对于高强度、高模量纤维的制备及高分子液晶的理论研究具有十分重要的意义。下面是PTA的主要合成路线。
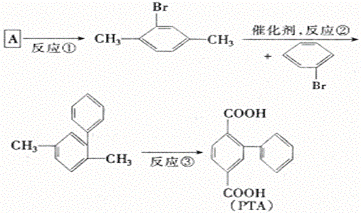
(1)上述反应中属于取代反应的是 。
(2)反应③所加试剂为 ,反应类型为 。
(3)A的结构简式为 ,名称 。
(4)A的同分异构体有 种,分别为(写结构简式)
七、(本题共2小题,20分)
25、(8分)某苯的衍生物,能与NaOH以等物质的量关系反应,已知该化合物中含氧17%,且碳与氢原子数目相等。取0.94g该晶体溶于2mol·L-1NaOH溶液20ml中,再用1mol·L-1硫酸中和过量的碱,硫酸用量为15ml。试推断该有机物的分子式和可能的结构简式。若要进一步确证是何种物质,还需要什么简单的实验事实予以证明。
26、(12分)在500mL FeCl3和CuCl2的混合溶液中,通入标准状况下4.48L H2S(已知2FeCl3 +H2S ===2FeCl2+S↓+2HCl),恰好与两种溶质完全反应,并生成0.2mol沉淀,过滤,往过滤液中加入适量铁粉,使其完全反应,最后将溶液蒸干得固体0.4mol,完成下列要求:
(1) 写出H2S通入FeCl3和CuCl2的混合溶液中发生反应的离子方程式;
___________________________ _______________________________。
(2)计算原混合溶液中FeCl3及CuCl2的物质的量浓度分别是多少?
试题答案
1. C 2 B 3 B 4 B 5 B 6 D 7 D 8 B 9 C D 10 C
11 B D 12 C 13 B D 14 C 15 B 16 B D 17 D 18 B
19.(1)6 2 4H2SO4 1 3 2/a 4
(2)HNO3(答NO![]() 或KNO3亦可)
或KNO3亦可)
(3)1 1
20、①C a②D a③E d④B d⑤A c
C6H5OH +NaOH→C6H5ONa + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑+H2O
21、(1)C +2H2SO4(浓)=====CO2↑+2SO2↑+2H2O
(2)B:品红溶液,证明生成了SO2;
C:酸性高锰酸钾,除去SO2;
D:品红溶液,检验SO2是否除尽;
E:澄清石灰水,证明CO2的存在。
(3)AB;无水CuSO4;无水CuSO4变蓝。
22、A溶液的电解产物中有两种单质,C与D的浓溶液共热能反应,稀溶液不反应,D由F和水反应生成推测D为含氧酸,再根据反应条件推测F为SO3,C为铜,B为O2,A为CuSO4,代入框图验证合理,即为答案。
答案:,A:CuSO4 D:CuSO4 F:SO3
2Cu +O2+2H2SO4==2 CuSO4+2H2O
23、(1)TiO2 (2)B(3)钝化(4)TiCl4+2H2O=TiO2+4HCl(5)AB
(6)BC(7)①TiO2+2Cl2+2C=TiCl4+4CO② TiCl4+2Mg=2MgCl2+Ti
24、(1)①②(2)酸性KMnO4或K2Cr2O7或强氧化剂 氧化反应
(3)对二甲苯(结构简式:略)(4) 4 乙苯、邻二甲苯、间二甲苯、对二甲苯(结构简式:略)
25、C6H6O,C6H5OH;可加入FeCl3溶液,若呈紫色即可证明一定有苯酚。
26、(1)H2S+2Fe3+==2Fe2++S↓+2H+;H2S+Cu2+==CuS↓+2H+
(2)4/15mol/L、4/15mol/L