高考化学热身小练习二
1.下列叙述不正确的是 ( )
A.淀粉、纤维素、油脂都属于天然高分子化合物
 B.能发生酯化反应的酸不一定都是羧酸
B.能发生酯化反应的酸不一定都是羧酸
C.天然蛋白蛋水解的最终产物均是α-氨基酸
D.油脂水解得到的醇是丙三醇
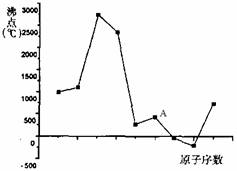
2.右图中曲线表示原子序数在前20号中的某些连续的元素单质沸点的变化规律(原子序数按递增顺序连续排列),其中A点表示的元素是 ( )
A.Si B.A1
C.Cl D.S
3.在体积恒定的密闭容器中,充入3 molA和1 molB发生反应3A(g)
+ B(g)![]() xC(g)
达到平衡后,C在平衡混合气中的体积分数为A%。若维持温度不变,以1.2 mol A、0.4 mol B、0.6 mol C为起始物质,达到平衡后C的体积分数仍为A%,则x值可能是
( )
xC(g)
达到平衡后,C在平衡混合气中的体积分数为A%。若维持温度不变,以1.2 mol A、0.4 mol B、0.6 mol C为起始物质,达到平衡后C的体积分数仍为A%,则x值可能是
( )
A.1 B.2 C.3 D.4
4.中学化学课本中有大量的数据材料,下面是某学生对数据的利用情况,其中不正确的是 ( )
A.利用液体密度可以判断液体物质挥发性的大小
B.利用固体溶解度数据可判断AgCl与KI溶液能否反应
C.由原子(或离子)半径数据可推断某些原子(或离子)的氧化性或还原性强弱
D.利用沸点数据可推测将一些液体混合物分离开来的可能性
5.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向CuSO4溶液中加入适量铁粉
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaI溶液中通入过量氯气
6.用氨水、苛性钠、盐酸中任何一种溶液作试剂都能鉴别的溶液组是 ( )
A.Al(NO3)3和AgNO3 B.Na2CO3和NaCl
C.Fe2(SO4)3和FeCl3 D.NH4Cl和MgCl2
7.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.在0.2L0.5mol/LAlCl3溶液中Al3+数目为0.1NA,是Cl-数目的1/3
B.标况下28gN2、CO混合气体中含有的原子数为2NA
C.电解饱和NaCl溶液时若共收集到22.4L气体(标况)则共转移电子数2NA
D.2g重氧水(H218O)含有中子数为NA
8.有6瓶白色固体,它们是Al2O3、NaNO3、Ba(OH)2、MgCl2、(NH4)2SO4、无水CuSO4,现仅有蒸馏水及已检出的物质对它们进行鉴别,则第二步实验中检出的物质是( )
A.NaNO3 B.Ba(OH)2 C.MgCl2 D.(NH4)2SO4
9.某学生为了将含有少量杂质铜的氯化铁提纯.拟定以下实验步骤:
①把样品加蒸馏水溶解;②过滤除去杂质;③把滤液加热蒸干得到FeCl3晶体。
(1)你认为此方案是否科学,试用化学方程式和简要文字表达其理由。
(2)请你设计提纯氯化铁方案(只要求写出提纯步骤,最多只允许6步完成).
10.剪约6cm长、2cm宽的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调在中间位置。取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL 0.5mol/L的硫酸溶液。试回答下列问题:
⑴两电极同时插入稀硫酸中,电流表的指针偏向 (填“铝”或“铜”)极,铝片上的电极反应式为 。
⑵两电极同时插入浓硝酸中,电流表的指针偏向 (填“铝”或“铜”)极,铝片上的电极反应式为 。
11.某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA-
HA-![]() H++A2-
H++A2-
回答下列问题:
⑴Na2A溶液现__________(填“酸性”,“中性”或“碱性”)。
⑵在0.1 mol·L-1Na2A溶液中,下列粒子浓度关系式正确的是__________________
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(H+)+c(Na+)=2c(A2-)+c(HA-)+c(OH-) D.c(Na+)=2c(A2-)+2c(HA-)
⑶已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能是_________0.11 mol·L-1(填“<”,“>”或“=”),理由是:____________
__________________________________________________________________________。
⑷0.1 mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是:
________________________________________________________。
12.某温度下硫酸铜的溶解度为40 g,向足量该温度下的饱和硫酸铜溶液中加入2 g无水硫酸铜,试计算析出晶体的质量(结果保留一位小数)。
《高考热身小练习二》参考答案
1.A 2.D 3.AD 4.A 5.BD 6.A 7.BD 8.B
9.(1)不科学 加水后发生反应2FeCl3+Cu==CuCl2+2FeCl2,引进新杂质CuCl2和FeCl2,且过滤不能除去;在溶液蒸干过程中FeCl3+3H2O![]() Fe(OH)3+3HCl↑
Fe(OH)3+3HCl↑
(2)①加蒸馏水溶解 ②加过量Fe粉 ③过滤除去Cu和过量Fe ④通入适量氯气⑤通入少量氯化氢气体 ⑥蒸发浓缩结晶得到FeCl3晶体
10.⑴铝 Al-3e-=Al3+ ⑵铜 2NO3-+4H++2e-=2NO2↑+2H2O
11.⑴碱性 ⑵BCD
⑶< 第一步电离出H+抑制第二步电离,使第二步电离出H+浓度小于0.1 mol·L-1
⑷c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
12.4.0g