高考化学填空题(无机理论部分)
1.(10分)请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式): 。
2.(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
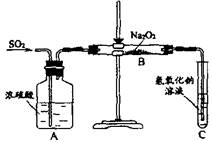
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:


![]()
![]()

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
3.(12分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
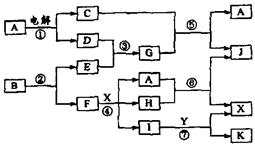
请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
(2)反应⑤的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。
4.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
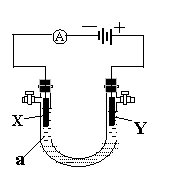 5.(15分)
5.(15分)
电解原理在化学工业中有广泛应用。右图表示一个电解池,
装有电解液a,X、Y都是惰性电极,通过导线与直流电源
相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始
时,同时在两极各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
⑵如果用电解法精炼铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为
②Y电极的材料是 ,电极反应式为
(说明:杂质发生的电极反应不必写出)
6.(14分)
| A | B | C | D | E | F | G | |
| A | — | — | — | — | — | —↓↓ | ↓ |
| B | — | — | — | — | ↓ | ↓ | ↓ |
| C | — | — | — | ↓ | — | ↓ | ↓ |
| D | — | — | ↓ | — | ↓ | ↓ | ↓ |
| E | — | ↓ | — | ↓ | — | ↓ | — |
| F | — | ↓ | ↓ | ↓ | ↓ | — | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | — | ↓ | — |
有A、B、C、D、E、F、G7瓶不同物质的溶液,
它们各是:Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、
Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,
各取少量溶液进行两两混合,实验结果如表所示。
表中“↓”表示生成沉淀或微溶化合物,“—”表示
观察不到明显变化。试回答下面问题:
⑴A的化学式是 ,G的化学式是 ,
判断的理由是 。
⑵写出其余几种物质的化学式。B: ,C: ,D: ,
E: ,F: 。
7.(16分)
恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下
![]() 反应:N2(g)
+ 3H2(g) 2NH3(g)
反应:N2(g)
+ 3H2(g) 2NH3(g)
⑴若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值。
⑵反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)。
n(始):n(平) = ,
⑷原混合气体中,a:b = ,
⑸达到平衡时,N2和H2的转化率之比,a(N2): a(H2) = ,
⑹平衡混合气体中,n(N2):n(H2):n(NH3) = 。
8. (15分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:![]() (气),
(气),![]() (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
_____________________________________________;
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是________________________________________。
9. (18分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
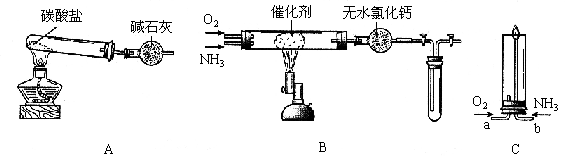
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________;碱石灰的作用是_______________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是_____________________________。
<2>停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因_________________________________________
_____________________________________________________________________________
____________________________________________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
<1>两气体通入的先后顺序是_______________________________________________,其理由是______________________________________________________________________
____________________________________________________________________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
10. (12分)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________g。
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为________。样品②中氧化铜质量为_________g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为_________________________________。
11.(9分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大
理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制
取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
(1)选用A装置可制取的气体有________________
选用B装置可制取的气体有________________
通常选用C装置制取的气体有________________
(2)标号①、②的仪器名称依次为________________ ,________________
(3)写出利用上述有关药品制取氨气的化学方程式:
________________________________________________
若要制得干燥的氨气,可选用下列干燥剂中的________________(填序号)
a.生石灰 b,浓硫酸 C.三五氧化二磷
12.(5分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的物质的量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
13.(l6分)
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15
L 6.0 mol·![]() 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_______________________________________________,产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是_________________________________________________
_________________________________________________________。
(3)③中所发生的各反应的离子方程式是_________________________________________________
_________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____________________________,
c(Fe2+)为____________________________________________________。
14.某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
 。
。
15.在一定条件下,二氧化碳和氧气发生如下反应:
![]() 2SO2(g)+
O2 (g)
2SO3(g) + Q
(Q>0)
2SO2(g)+
O2 (g)
2SO3(g) + Q
(Q>0)
(1) 写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度
(以上均填增大、减小或不变)
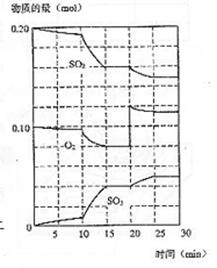
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
16.右表是元素周期表的一部分。
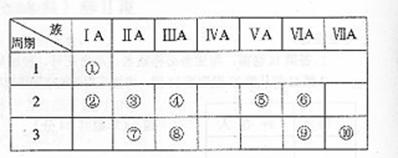
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号) .
答案
1.(10分) ⑴100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
⑵溶解 过滤 (3)BaCl2[或Ba(OH)2]、K2CO3、HCl
2.(12分)(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
3.(12分)(1)H2O N2 Ag
HCl (2)4NH3+5O2![]() 4NO+6H2O (3)AgN3,
4NO+6H2O (3)AgN3,
4.(6分)(1)N2 CO; CO2 N2O (2)SO2、 O3
5.(15分)
⑴①2H+ + 2e - = H2↑ 放出气体,溶液变红。
②2Cl - - 2e - = Cl2 ↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
⑵①纯铜 Cu2+ + 2e - = Cu ②粗铜Cu - 2e - = Cu2+
6.(14分)⑴KCl,AgNO3。混合时只生成一种沉淀的是KCl,生成的是AgCl,所以A是KCl,G是AgNO3。 ⑵B:Na2SO4 C:MgCl2 D:Na2CO3 E:Ca(NO3)2 F:Ba(OH)2
7.(16分)
![]() ⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16
⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16
解法二:N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) = 716.8L -1
×25% = 32mol×25% = 8mol
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
8. (15分)
(1)<1>H2 <2>![]()
(2)<1>SO2
<2>![]()
<3>![]()
9. (18分)
(1)<1>![]() [或
[或![]() ] <2>吸收水和二氧化碳
] <2>吸收水和二氧化碳
(2)<1>![]()
![]()
![]()
(3)<1>先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
<2>![]()
10. (12分)
(1)6.0
(2)C ![]()
(3)![]()
|
|
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
1mol 22.4L
n(CuSO4) 22.4L
1mol:n(CuSO4)=22.4L:2.24L
n(CuSO4)=0.1mol (2分)
(2)c(CuSO4)=0.1mol/0.5L=0.2mol/L (1分)
说明:(1)化学非选择题其它合理答案可参照评分标准给分.
(2)化学方程式和离子方程式每题2分,正确写出反应物和生成物得1分;未配
平或加热符号、气体符号漏写扣1分;但只要反应物或生成物写错或漏写则扣2分.
13.(1)加少量KClO3,插上Mg条并将其点燃 Fe
(2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O
(3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3
(4)c(Mg2+= 0.67mol·![]() , c(Fe2 = 2.3mol·
, c(Fe2 = 2.3mol·![]() 。
。
14.(1)KMnO4 (2)① 8 ②
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
15.(1)![]() (2)增大 增大 减小 (3)15-20
min和25-30
min
(2)增大 增大 减小 (3)15-20
min和25-30
min
(4)增加了O2的量 a b
|
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O Li