《电化学》检测题
第I卷、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.以下现象与电化腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
2.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用,它的充电放电反应按下式进行:
![]()
由此可知,该电池放电时的负极材料是( )
A.![]() B.
B.![]() C.Cd D.
C.Cd D.![]()
3.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A.![]()
B.![]()
C.![]()
D.![]()
4.用石墨电极在一定温度下电解K2SO4饱和溶液m g。当阴极产生a mol气体时,从溶液中析出n g无水晶体。则剩余溶液的溶质质量分数是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.下列图1试管中的铁钉腐蚀最快的是( )
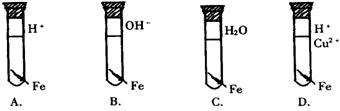
图1
6.有A、B、C、D四种金属。将A与B用导线连结起来浸入电解质溶液中,B不易腐蚀。将A、D投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D、C、A、B B.D、A、B、C
C.D、B、A、C D.B、A、D、C
7.下列有关实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀![]() 中,铜片表面出现气泡
中,铜片表面出现气泡
B.用锌片作阳极,铁片作阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
8.(2003广东,16).用惰性电极实现电解,下列说法正确的是 ( )
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
9.(2004年广东、广西).PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是 ( )
A、NaOH B、H2SO4 C、AgNO3 D、Na2SO4
10.(2004年上海化学).下图2中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
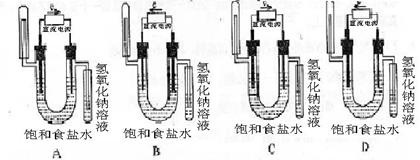
图 2
11.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G![]() Q+NaCl
(2)Q+H2O
Q+NaCl
(2)Q+H2O![]() X+H2
X+H2
(3)Y+NaOH![]() G+Q+H2O (4)Z+NaOH
G+Q+H2O (4)Z+NaOH![]() Q+X+H2O
Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
12.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42-====PbSO4+2e-,正极PbO2+4H++SO42-+2e-====PbSO4+2H2O今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
13.(2002上海).某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图3的装置,则对电源电极名称和消毒液的主要成分判断正确的是 ( )
(A) a为正极,b为负极;NaClO和NaCl
(B)  a为负极,b为正极;NaClO和NaCl
a为负极,b为正极;NaClO和NaCl
(C) a为阳极,b为阴极;HClO和NaCl
(D) a为阴极,b为阳极;HClO和NaCl
图 3
14.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶
液的玻璃皿中(如图4所示平面图),经过一段时间后,
首先观察到溶液变红的区域是( )
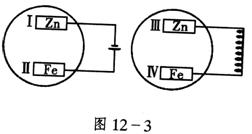
A.Ⅰ和Ⅱ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
15.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
16.在外界提供相同电量的条件下,![]() 或
或![]() 分别按
分别按![]() 或
或![]() 在电极上放电,其析出铜的质量为1.92g,则析出银的质量为( )
在电极上放电,其析出铜的质量为1.92g,则析出银的质量为( )
A.1.62g B.6.48g C.3.24g D.12.96g
 第Ⅱ卷 (非选择题 共62分)
第Ⅱ卷 (非选择题 共62分)
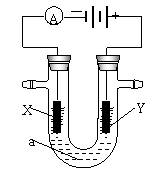
17.(2004年福建·浙江理综,27)、(16分)电解原理在化学工业中有广泛应用。右图5表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
图5
②Y电极上的电极反应式为 。检验该电极反应产物的方
法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
18.(12分)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电极放电时发生的化学反应方程式是___________________________________。
(2)此电极的正极发生的电极反应式是_______________________;负极发生的电极反应式是_______________________________。
(3)电解液中的![]() 离子向______________极移动;向外电路释放电子的电极是_____________。
离子向______________极移动;向外电路释放电子的电极是_____________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是______________________。
19.(16分)由于![]() 极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的
极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的![]() 沉淀。若用图6所示实验装置可制得纯净的
沉淀。若用图6所示实验装置可制得纯净的![]() 沉淀。两极材料分别为石墨和铁。
沉淀。两极材料分别为石墨和铁。
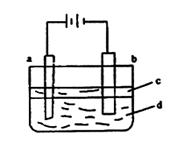
图6
①a电极材料为 ,其电极反应式为 。
②电解液d可以是 ,则白色沉淀在电极上生成;也可以是 ,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.![]() 溶液 C.
溶液 C.![]() 溶液 D.
溶液 D.![]() 溶液
溶液
③液体c为苯,其作用是 ,在加入苯之前,对d溶液进行加热处理的目的是 。
④为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为![]() 溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为
。
溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为
。
20.(18分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图7如下
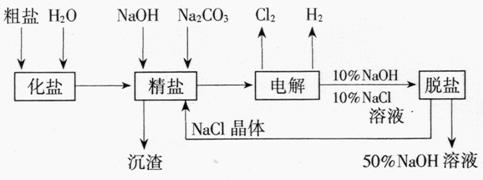
图7
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 , 。
答案卷
班次 姓名 学号
第I卷(选择题 共16题 每题3分 总计48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题,共62分)
17、(16分)(1)① , ;
② , 。
(2)① , ;
② , 。
18、(12分)(1) ;
(2) , ;
(3) , ;
(4) 。
19、(16分)(1) , ;
(2) , ;
(3) , ;
(4) ; (5) 。
20、(18分)(1) , ;
(2) ;
(3) ;
(4)
(5) ;
(6) , 。
参考答案:第I卷
1.D 2.C 3.D 4.C 5.D 6.B 7.C 8.D 9. A 10 D
11.C 12.C 13.B 14.B 15. C 16. B
第Ⅱ卷
17.答案1)①2H++2e-=H2↑ 放出气体,溶液变红
②2Cl—2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-=Cu ②粗铜 Cu—2e-=Cu2+
18.(1)![]() (2)
(2)![]()
![]() (3)正;负极
(4)燃料电池减少了对空气的污染
(3)正;负极
(4)燃料电池减少了对空气的污染
19.①Fe;![]() ②C; B
②C; B
③隔绝空气防止![]() 被空气氧化;排尽溶液中的氧气,防止生成的
被空气氧化;排尽溶液中的氧气,防止生成的![]() 在溶液中氧化
在溶液中氧化
④B、C ⑤白色沉淀迅速变化成灰绿色,最后变成红褐色
20. (1)2Cl--2e-====Cl2;升高
(2)Ca2++CO![]() =====CaCO3↓
=====CaCO3↓
Mg2++2OH-====Mg(OH)2↓
(3)a、c (4)b、c (5)蒸发;过滤
(6)NaCl+H2O=====NaClO+H2↑
或2NaCl+2H2O=======H2↑+Cl2↑+2NaOH
Cl2+2NaOH====NaCl+NaClO+H2O