《化学反应速率 化学平衡》检测题
第I卷
一、选择题(共8小题,每小题4分,每小题只有一个答案符合题意)
( ) 1.
1.![]() 与稀盐酸反应(放热反应)生成
与稀盐酸反应(放热反应)生成![]() 的量与反应时间的关系如下图所示.下列结论不正确的是
的量与反应时间的关系如下图所示.下列结论不正确的是
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应在第2min到第4min间生成![]() 的平均反应速率为
的平均反应速率为![]()
![]() ( )2.一定温度下,某密闭容器中的反应为:aX(g)+bY(g)) cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则
( )2.一定温度下,某密闭容器中的反应为:aX(g)+bY(g)) cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则![]() 为
为
A.3:1:2:1 B.1:3:2:2 C.1:3:1:2 D.3:1:2:2
( )3.下列事实不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置于低温处
B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.实验室常用排饱和食盐水的方法收集氯气
( )4.一定条件下,往容积恒定的密闭容器中投入2molA和1molB,发生可逆反应:
![]() 2A(g)+B(g)
C(g)+D(s),达到平衡时,测得压强为原压强的5/6,则A的转化率为
2A(g)+B(g)
C(g)+D(s),达到平衡时,测得压强为原压强的5/6,则A的转化率为
A.25% B.40% C.50% D.75%
![]() ( )5.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
( )5.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
![]() ( )6.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
( )6.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
A.平衡向右移动 B.x+y>z
C.B的转化率提高 D.C的体积分数增加
( )7.在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)
![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1,下列判断正确的是
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
![]() ( )8.在一个固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2 N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
( )8.在一个固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2 N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
二、选择题(共10小题,每题5分,每小题有1-2个答案符合题意)
![]() ( )9.在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%,则x的值为
( )9.在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%,则x的值为
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
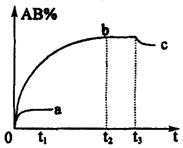
( )10.反应![]()
![]() 2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如下图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间
2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如下图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间![]() 开始向容器中加压的情况.则下列叙述正确的是
开始向容器中加压的情况.则下列叙述正确的是
|
B.AB为气体,![]() 、
、![]() 中至少有一种为非气体,Q<0
中至少有一种为非气体,Q<0
C.AB为气体,![]() 、
、![]() 中有一种为非气体,Q<0
中有一种为非气体,Q<0
D.AB为固体,![]() 、
、![]() 中有一种为非气体,Q>0
中有一种为非气体,Q>0
![]() ( )11.已知某温度下,N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol恒温、恒容且体积相同的两个密闭容器A、B,A中通入1molN2、3molH2,B中通入0.5molN2、1.5molH2,反应一段时间后,测得两个容器中气体密度均不发生变化。下列判断正确的是
( )11.已知某温度下,N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol恒温、恒容且体积相同的两个密闭容器A、B,A中通入1molN2、3molH2,B中通入0.5molN2、1.5molH2,反应一段时间后,测得两个容器中气体密度均不发生变化。下列判断正确的是
A.A中吸热92.4kJ B.B中放热46.2kJ
C.A中热量变化值一定大小B中2倍 D.A、B中均已达到平衡状态
![]() ( )12.反应3X(g)+Y(g) Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为
( )12.反应3X(g)+Y(g) Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
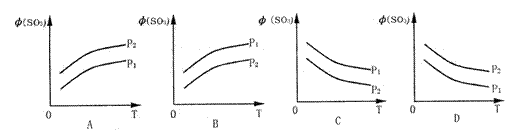
![]() ( )13.如图所示,反应2SO2(g)+O2(g) 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
( )13.如图所示,反应2SO2(g)+O2(g) 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积![]() (SO3)随温度变化的曲线应为
(SO3)随温度变化的曲线应为
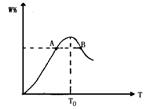
( )14.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
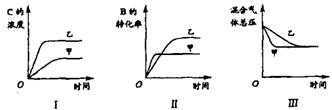
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
( )15.X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y![]() 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
( )16.在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
| 序号 | 锌的质量(g) | 锌的形状 | 温度(℃) | 完全溶解于 酸的时间(s) |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 30 | t1 |
| E | 2 | 薄片 | 35 | 50 |
| F | 2 | 颗粒 | 15 | t2 |
| G | 2 | 粉末 | 15 | t3 |
则下列说法正确的是①![]() =75s ②
=75s ②![]() >200>
>200>![]() ③单位时间内消耗的锌的质量
③单位时间内消耗的锌的质量![]()
A.① B.①② C.只有② D.全部正确
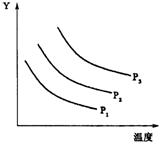 ( )17.下图表示可逆反应L(固)+G(气)
( )17.下图表示可逆反应L(固)+G(气)![]() 2R(气)在不同温度、压强下,达平衡状态时有关量的关系,已知
2R(气)在不同温度、压强下,达平衡状态时有关量的关系,已知![]() ,下列说法中正确的是
,下列说法中正确的是
A.Y轴表示R的体积分数,正反应为放热反应
B.Y轴表示G的体积分数,正反应为吸热反应
C.Y轴表示L的质量,正反应为放热反应
D.Y轴表示R的分解率,正反应为吸热反应
|
图所示,则X,Y的反应方程式可表示为
A.2X+Y![]() 3Z B.3X+2Y
3Z B.3X+2Y![]() 2Z
2Z
C.X+3Y![]() Z D.3X+Y
Z D.3X+Y![]() Z
Z
《化学反应速率 化学平衡》检测题答卷
班级 姓名
选择题答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 |
|
|
|
|
|
|
|
| ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
第II卷
三、填空题
19.(10分)在密闭容器中,通入AmolN2和BmolH2,在一定条件下达到平衡,容器中还剩余CmolN2,
(1)生成NH3的物质的量为 ; (2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率 ,逆反应速率 ,
N2转化率 。(填“变大”、“变小”、“不变”)
|
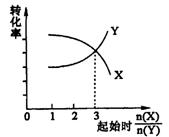
![]() 混合,发生如下反应:2X+Y 2W.
混合,发生如下反应:2X+Y 2W.
在反应过程中W的物质的量分数随温度变
化如图所示:
(1)T0对应的V正和V逆的关系是V正 V逆 (填“>”、“<”或“=”);
(2)此反应的正反应为 热反应;
(3)A、B两点正反应速率的大小关系是A B(填“>”、“<”或“=”);
(4)温度T<T0时,W%逐渐增大的原因是 ;
(5)若B点的W的物质的量分数为40.0%,则参加反应的X的物质的量为 。
![]()
![]() 21.(12分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应。
21.(12分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应。
(1)当上述两个反应达到平衡时,至少要知道两种气体的平衡浓度才能计算出平衡时混合物的组成,但这两种气体不能同时是 和 ,或 和 (填它们的分子式)。
(2)若平衡时,O2和CO2的物质的量分别为a mol和b mol ,则n(H2O)平为 mol (用含a、b的代数式表示)。
22.(12分)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
四、计算题
![]() 23.(16分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2 (g) + 3 H2(g) 2NH3(g)
23.(16分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2 (g) + 3 H2(g) 2NH3(g)
(1)若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比,n(始)∶n(平) = 。(写出最简整数比,下同)
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
参考答案
选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | A | D | B | A | C | B | B | A | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | C | AD | C | AB | B | C | A | D |
19.(1)2(A-C)mol (2)3(A-C)/B (3)变大 变大 变大
20.(1)V正=V逆 (2)放 (3)A<B (4)反应未达
到平衡状态,还在向正反方向进行,即V正>V逆,故W%逐渐增大 (5)1.33mol
21.(1)H2和H2O;CO和(CO2) (2)2—2a—b
22.(1)3.5mol (2)2.0<x<3.0(3)1.5<x<2.0
![]() 23.⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3
a = 13 + 3 = 16
23.⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3
a = 13 + 3 = 16
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成
6 mol NH3,消耗了3 mol N2,所以a
= 13 + 3 = 16
⑵n平(NH3) = 716.8L -1
×25% = 32mol×25% = 8mol
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2