《化学平衡》单元试卷
一、选择题(下列各题只有1-2个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
![]() 1.在一定条件下,反应:A2(气)+B2(气)
2AB(气)达到平衡的标志是
1.在一定条件下,反应:A2(气)+B2(气)
2AB(气)达到平衡的标志是
A、正、逆反应同时进行的状态
B、正、逆反应速率相等,且均为0的状态
C、A2、B2、AB三者浓度相等
D、A2、B2、AB三者在混合物中体积百分组成保持不变
![]() 2、 对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
2、 对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
A.VNH3 = 0.2mol·L-1·s-1 B.VO2 = 0.24 mol·L-1·s-1
C. VH2O = 0.25 mol·L-1·s-1 D. VNO = 0.15 mol·L-1·s-1
3、在密闭容器中进行如下反应:X2(气) + Y2(气) ![]() 2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
A. Z 为 0.3 mol/L B. Y2 为 0.35 mol/L
![]() C. X2
为 0.2
mol/L
D. Z 为 0.4 mol/L
C. X2
为 0.2
mol/L
D. Z 为 0.4 mol/L
4、在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
A. HI、H2、I2的浓度相等 B. 混合气体的颜色不变化时
![]() C. 混合气体的总压不变时 D. v(HI):v(H2):v(I2)=2:1:1时
C. 混合气体的总压不变时 D. v(HI):v(H2):v(I2)=2:1:1时
5、 密闭容器中,反应xA(g) + yB(g) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是:
A. x+y < z B. 平衡向正反应方向移动 C. B的转化率降低 D. C的体积分数下降
6、向0.1mol/L氨水中逐渐加入一定量的水,始终保持增大趋势的是:
A. NH3·H2O的浓度 B. OH -的浓度 C. NH4+ 的数目 D. NH4+的浓度
7、某温度下, 在固定体积的密闭容器中, 可逆反应 A(气) + 3B(气) ![]() 2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A、B、C,则
2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A、B、C,则
A、平衡正向移动 B、平衡不移动
C、平衡时C的体积分数增大 D、平衡时C的体积分数可能变小
8、在一个6L的密闭容器中,放入3LX(气)和2LY(气),在一定条件下发生下列反应
![]() 4X(气)+3Y
(气) 2Q(气)+nR(气)。达到平衡后,容器内温度不变,混合气体的压强
4X(气)+3Y
(气) 2Q(气)+nR(气)。达到平衡后,容器内温度不变,混合气体的压强
比原来增加5%,X的浓度减小1/3,则该反应式中n值是
A. 3 B.
4
C. 5 D.
6
9、在25℃、1.01×105Pa状态下,相同容积的甲、乙两个密闭容器,甲中盛放N2,乙中盛放NO2和N2O4混合气体。若将甲、乙两容器同时冷却降温到0℃,则此时甲、乙两容器内的压强关系是
A.P甲>P乙 B.P甲<P乙 C.P甲=P乙 D.P甲=P乙=1.01×105Pa
![]()
 |
10、下列表示可逆反应:2A(气)+B(气) D(气)+Q(Q>0)的图示中正确的是
A. B. C. D.
11、有一可逆反应:![]() ,若按下列两种配比在同温同体积的密闭容器中进行反应:
,若按下列两种配比在同温同体积的密闭容器中进行反应:
(1)![]()
(2)![]()
达到平衡后,C的质量分数相等,则方程式中![]() 值为
值为
A. 1 B. 2 C. 3 D. 4
12、下列能用勒沙特列原理解释的是
①棕红色NO2加压后颜色先变深后变浅 ②.FeCl3溶液加热后颜色加深 ③.Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下 ⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 ⑥. SO2催化氧化成SO3的反应,往往加入过量的空气
⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成
A.①②⑤⑥ B.②③④⑦. C.①③⑤⑦ D.全部
 13、 可逆反应mA(s)+nB(g)
13、 可逆反应mA(s)+nB(g)![]() pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正反应方向移动
D.化学方程式中一定n>p+q
14、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:
![]() A(气)+2B(气) 2C(气)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占40%,则下列推断正确的是
A(气)+2B(气) 2C(气)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占40%,则下列推断正确的是
A.原混合气体的体积为1.1V B. 原混合气体体积为1.2V
C.反应达到平衡时,气体A消耗了0.2V D.反应达到平衡时,气体B消耗了0.2V
15.反应:2A(气) B(气)+xC(气),在一定条件下达到平衡,密闭容器内压强增大了p%,测得A的转化率为p%,则x的值为
A、1 B、2 C、3 D、4
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空题(共26分)
![]() 16、(10分)在密闭容器中进行可逆反应:
CO(气)+NO2(气) CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是:
16、(10分)在密闭容器中进行可逆反应:
CO(气)+NO2(气) CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通人CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
17、(10分)在一定条件下,反应A(气)+B(气)![]() C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
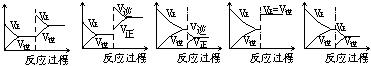
A. B. C. D. E.
(1)升温,达到新的平衡的是( ) (2)降压,达到新的平衡的是( )
(3)减少C的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是( )
18、(6分)现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
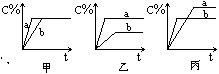
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则_ __曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_ __ __热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则__ __曲线是表示压强较大的情况。
![]() 三、计算题(共14分)
三、计算题(共14分)
19、(5分)在一定条件下,可逆反应A2+B2 2C,达到化学平衡状态,经测得平衡时:[A2]=0.5 mol /L,[B2]=0.1 mol /L,[C]=1.6 mol /L,若A2,B2,C的起始浓度分别用amol/L,bmol/L,cmol/L表示,要维持相同的平衡状态,请回答:
(1)a,b应满足的关系是:
2
(2)a的取值范围是: 。
20.(9分)将N2和H2按一定比例混和,在相同状况下其密度是H2的3.6倍,取0.5摩该混合气体盛入密闭容器内使之发生反应,并在一定条件下达到平衡。已知平衡后容器内压强是相同条件下反应前压强的0.76倍,试求下列各量:
(1)反应前混合气体中N2与H2的体积比。
(2)达平衡时混合气体中氨的物质的量。
(3)平衡时没有反应的H2是原来的百分之几?