高三级化学训练题三
1. 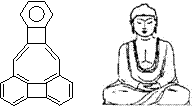 美国康乃尔大学的魏考克斯(C. Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛。因而称为释迦牟尼分子(所有原子在同一平面)。有关该有机分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C. Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛。因而称为释迦牟尼分子(所有原子在同一平面)。有关该有机分子的说法不正确的是( )
A、该有机物属于芳香烃
B、该有机物属于苯的同系物
C、该有机物分子中含有22个碳原子
D、该有机物一氯代物只有6种
2. 室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
3. X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y
A、只有① B、只有②③ C、只有①④ D、①②③④
4. 类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
5. 在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300oC,经充分反应后排出气体,则残留固体及其物质的量正确的是( )
| A | B | C | D | |
| 反应前 | 1molNaOH、1molNaHCO3 | 1molNa2O、1molNaHCO3 | 1mo1Na2O2、lmolNaHCO3 | 1molNa2O2、1molNH4HCO3 |
| 反应后 | 1molNa2CO3 | 2molNaOH、0.5molNa2CO3 | 2molNaOH、0.5molNa2CO3 | 1molNa2CO3 |
6. 化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B—→X+C,X是一种单质,由此可知X元素( )
A、一定是金属元素
B、一定是非金属元素
C、可能是金属元素,也可能是非金属元素 D、无法确定
7.
有四种金属A、B、C、D,它们与浓HNO3反应时,只有A不反应,把这四种混合物加入盐酸,其中B、C溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到C离子的沉淀,则这四种金属的活动性强弱的顺序可能是( )
A.BCDA B.ABCD C.CBDA D.DCBA
8. 某酸根离子RO![]() 所含电子数比硝酸根离子NO
所含电子数比硝酸根离子NO![]() 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
①R原子的电子层数比N原子的电子层数多1 ②RO![]() 中R元素与NO
中R元素与NO![]() 中N元素的化合价相同 ③RO
中N元素的化合价相同 ③RO![]() 与NO
与NO![]() 只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
A.①③④ B.①②④ C.①② D.③④
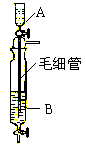 9. Inorganic Syntheses一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
9. Inorganic Syntheses一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
(A)A中装浓硫酸,B中装浓盐酸
(B)A中装浓盐酸,B中装浓硫酸
(C)A中装氢氧化钠浓溶液,B中装浓氨水
(D)A中装浓氨水,B中装氢氧化钠浓溶液
10. 每次焰色反应实验都要用试剂洗净铂丝,这种试剂是
其理由是 。
A、Na2CO3溶液 B、NaOH溶液 C、硫酸 D、盐酸
答案:选D. A、B中含有Na+,会干扰焰色反应,C中硫酸不挥发,其盐高温也不易挥发,洗涤时不可能洗净铂丝上粘有的物质,而盐酸易挥发,其盐高温时也易挥发,灼烧时,盐酸及其盐可一起挥发掉,以达洗净的目的,故选D。
11. 某同学中和滴定实验的过程如下:
(A)取一支碱式滴定管,(B)用蒸馏水洗净,(C)加入待测的NaOH溶液,(D)记录液面刻度读数,(E)用酸式滴定管精确放出定量标准酸液,(F)置于未经标准酸液润洗得洁净锥形瓶中,(G)加入适量蒸馏水,(H)加入酚酞试液2滴,(I)滴定时,边滴加摇荡,(J)边注视滴定管液面的变化,(K)当小心滴到溶液由无色变成粉红色时,停止滴定。(L)记录液面刻度读数,(M)根据滴定管的两次读数得出NaOH溶液体积为22mL,
指出上述实验过程中的错误之处(用编号表示)____________________;其原因是 。
答案:选C、J、K、M.
其理由是:C、盛待测NaOH溶液的滴定管未用该NaOH溶液润洗;
J、滴定时眼睛要注视锥形瓶内溶液的颜色变化和滴液的流速;
K、要滴至溶液由无色变成粉红色至半分钟内不再褪去为止;
M、记录NaOH溶液体积,根据滴定管测量准确度,应记录到小数点后两位,即22.00mL。
12. (1)已知下列反应在一定条件下可以发生:
H2O2+2Fe2++2H+====2Fe3++2H2O H2O2+2Fe3+====2Fe2++O2↑+2H+
在以上反应中Fe2+实际上起着 作用,总反应式为
(2)I2也与Fe2+一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式: H2O2+I2====2HIO :
总反应式为:
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:
H2O2+2I-=I2+O2↑+2H+,这个方程式正确吗?
若正确,理由是
(若认为不正确,该步不必作答)
若不正确,原因是
![]() (若认为正确,该步不必作答),并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):
。
(若认为正确,该步不必作答),并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):
。
![]() 答案:(1)催化剂(或催化)(1分),2H2O2
2H2O+O2↑(1分)
答案:(1)催化剂(或催化)(1分),2H2O2
2H2O+O2↑(1分)
(2)2HIO+H2O2=I2+2H2O+O2(2分) 2H2O2 2H2O+O2↑(1分)
![]() (3)不正确(1分),O元素和I元素的化合价均上升,没有化合价降低的元素(或违背电荷守衡原理)(1分),
(3)不正确(1分),O元素和I元素的化合价均上升,没有化合价降低的元素(或违背电荷守衡原理)(1分),
H2O2+2I-+2H+=2H2O+I2(1分) 2H2O2 2H2O+O2↑(1分)
13. 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
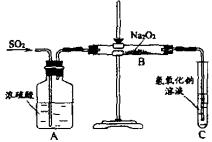
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
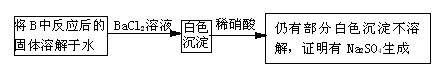
上述方案是否合理? 。请简要说明两点理由:
①
;②
。
答案:(1) 2Na2O2+2SO2=2Na2SO3+O2
(2)取少量白色固体放入试管中,加入稀硫酸,将生成的气体通入品红试液中,品红褪色,证明含有Na2SO3.
(3)不合理, ①残留的Na2O2将溶解后的Na2SO3氧化为硫酸钠
②加入的硝酸将溶解后的Na2SO3氧化为硫酸钠
14. 海带是一种重要的工业原料,用它可以提取碘。
(1)从海带中提取碘有如下步骤:
①通入足量Cl2 ②将海带焙烧成灰后加水搅拌、煮沸2~3分钟
③加CCl4振荡 ④用分液漏斗分液 ⑤过滤
合理的操作顺序是
A. ①②③④⑤ B. ②⑤①③④ C. ①③⑤②④ D. ②①③⑤④
(2)第③步操作的名称是_____________,能选用CCl4原因是
_____________________________________________________________。
(3)下列物质中,不能用于代替CCl4进行第③步操作的溶剂是___________。
A.苯
B.裂化汽油 C.酒精
答案:(1)B (2)萃取,CCl4与水不互溶,且I2在CCl4中的溶解度比在水中的溶解度大很多 (3)BC
15. 已知Al、Cu、Hg三种金属分别用如下方法冶炼:
![]()
|
|
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是
_______________________________________________________________。
(2)利用(1)中的结论,并结合题目信息,写出工业上用CaCl2冶炼金属钙的化学方程式________________________________________________。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程式_____________________________________。
答案:
|
|
(3)4Al + 3MnO2 ==== 2Al2O3 + 3Mn
16. 推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为______。
⑷某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
答案:⑴CaF2 CS2 (2)MgS (3)NaOH 或 LiHS
(4)H2b-mXOb (5)KCl 或CaCl2
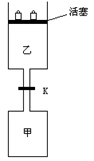 17. 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
17. 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
答案:(1)20%(4分)(2)后者大 (2分) (3)0.29V(4分)18.
19. 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
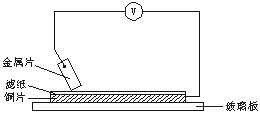
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
已知:构成两电极的金属活泼性相差越大,电压表的读数越大。
请依据表中数据判断:
(1)______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)金属。其对应的原电池的电极反应式为:
负极_______________,正极_________________。
答案:(1)C (2分) B (2分)
(2)B (2分) 2Cu+4OH--4e-====2Cu(OH)2(或2Cu-4e-====2Cu2+)
(3分) 2H2O+O2+4e-====4OH-(3分)
|
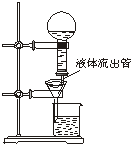
答案:(1)A(2分) C(2分)
(2)待过滤的液体沿液体流出管流入漏斗,当漏斗里的液面封住“空气导入管”的管口时,空气停止进入烧瓶,液体停止流入漏斗;随着过滤的进行,当漏斗里的液面降到空气导入管的下口以下时,空气又进入烧瓶,液体又流入漏斗。(3分)
|
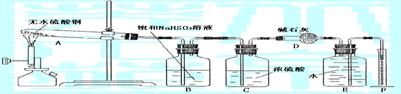
试回答: (1)加热过程中,试管A中发生的实验现象可能有 。
(2)装置E和F的作用是 ;
(3)该学生作用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确吗?为什么?
(4)该学生使用装置C的本意是想用C来除去混合气体中的水分,这种做法有无必要?为什么?
(5)另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为 mol,三氧化硫为 mol。
(6)由上述实验数据可知无水硫酸铜受热分解的化学方程式为
。
答案:(1)白色固体变黑(2分)
(2)测量生成氧气的体积(2分)
(3)不正确。因为氧气也能与B中的溶液发生反应(2分)
(4)没必要。因为气体通过E后,又混入了水分(2分)
|
(6)3CuSO4 3CuO+2SO2↑+SO3↑+O2↑(2分)
22. 按下列反应的化学方程式,在水溶液中N2H5+离子将Fe3+还原为Fe2+:N2H5++4Fe3+→4Fe2++Y+…作为N2H5+离子的氧化产物Y可能是_______?
解答:4个Fe3+获得4个电子,在N2H5+中2个N原子显-2价,共应失去4个电子而变为0价,即得N2.
23. 已知NaBiO3是黄色、微溶于水的固体;Bi3+为无色。将NaBiO3固体加入到MnSO4和H2SO4的混合溶液中,加热,得紫色的混合溶液。试写出该反应的离子方程式。
解答: 写该反应离子方程式易出错的地方有①NaBiO3要写成分子式,不能拆写成离子形式。②NaBiO3的还原产物为Bi3+。③Mn2+的氧化产物为MnO4-。④配平时要注意电子守恒、电荷守恒和原子守恒。
答案:5NaBiO3+2Mn2++14H+=5Na++5Bi3++2MnO4-+7H2O