高三理科综合10月月考题化学卷 (化学)
6、下列有关实验中,用所选用的试剂(括号内物质)不能达到目的的是( )
A.检验Na2SO4溶液中是否混有NaCl(AgNO3溶液)
B.证明FeCl2溶液被氧化(KSCN溶液)
C.除去C2H2气体中的H2S气体(CuSO4溶液)
D.鉴别SO2和CO2两种气体(溴水)
7、硫代硫酸钠可作为脱氯剂,已知25.0ml 0.100mol/LNa2S2O3溶液恰好把224ml(标态)Cl2完全转化为Cl-,则S2O32-将转化为( )
A、S2- B、S C、SO32- D、SO42-
8、某溶液中含有HCO3- 、SO32- 、CO32- 、NH4+ 离子,向其中加入Na 2 O 2 固体,溶液中离子浓度增加的是 ( )
A.HCO3- B. NH4+ C. CO32- D.SO32-
9、强碱与强酸在稀溶液中发生中和反应的热效应:
H + (aq)+OH - (aq)=H 2 O(l);ΔH=-57.3kJ/mol , 取三份100mL0.5mol·L -1 的NaOH溶液,分别用0.5mol·L-1
醋酸溶液、18mol·L-1
硫酸溶液、1mol·L-1 硝酸溶液进行中和。若反应恰好完全时的热效应分别为ΔH 1 、ΔH 2 、ΔH 3 ,它们的正确关系是 ( )
A.ΔH 1 >ΔH 2 >ΔH 3 B.ΔH 2 >ΔH 1 >ΔH 3
C.ΔH 1 >ΔH 3 >ΔH 2 D.ΔH 2 >ΔH 3 >ΔH 1
10、下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量CO2 Ca2+ + 2ClO-+H2O+CO2=CaCO3↓+2HClO
B.FeSO4溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量SO2 NH3·H2O+SO2=NH![]() +HSO
+HSO![]()
D.氯化铝溶液滴入过量氢氧化钠溶液 Al3++4OH-=AlO![]() +2H2O
+2H2O
11、已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法正确的是( )
A.氧化产物与还原产物的物质的量比为1:2
B.若在标准状况下产生11.2LCl2,转移电子的物质妁量为1mol
C.I2的还原性强于Cl2
D.Cl2和I2都是氧化剂
12、下列说法不正确的是( )
A.胶体能发生电泳现象是由于胶体粒子带电
B.HF的沸点比HCl沸点高,是由于HF分子之间存在氢键
C.SiCl4的熔点比SiF4的熔点高,是由于它们的晶体类型不同
D.福尔马林可以保存动物标本,是由于福尔马林可以使蛋白质变性
13、用石墨电极电解500mL含足量KCl的溶液,若通过xmol电子的电量,则溶液的pH与x的关系是(假设电解前后溶液的体积不变)
A.pH==14+lg2x B.pH==14-lg2x C.pH==14+lgx D.pH==-lgx
26(15分)、工业甲醇的质量分数可以用下列方法测定:
①在稀![]() 中甲醇被
中甲醇被![]() 氧化成
氧化成![]() 和
和![]() ,反应式为:
,反应式为:
![]()
②过量的![]() 可用Fe2+与之完全反应:
可用Fe2+与之完全反应:
___![]() _____
_____![]() _____H+ == _____
_____H+ == _____![]() _____
_____![]() _____
_____![]()
现有![]() 工业甲醇,在
工业甲醇,在![]() 溶液中与
溶液中与![]() 溶液反应,多余的
溶液反应,多余的![]() 再用
再用![]() 与其反应,结果用去
与其反应,结果用去![]() 溶液
溶液![]() 。
。
(1)配平第②步中离子方程式(请直接在题中短线上填写答案)。
(2)计算工业甲醇的质量分数。
27(12分)、A、B、C、D分别是硝酸钡、氨水、氢氧化钠和碳酸氢钠四种溶液的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。
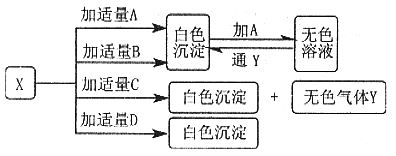 |
请写出:
(1)化学式A ,B , D
(2)X与C反应的离子方程式 。
28(17分)、已知X是一种复盐,C、D、E、H均为气体,F为白色不溶于水易被氧化的物质;反应①是工业生产中的重要反应,反应④⑥⑦是实验室重要的物质检验反应,这些物质有如下图所示的转化关系(生成物中的水均已略去)。
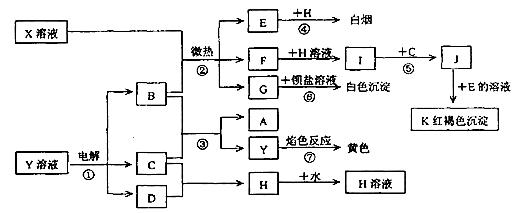
试回答:
(1)写出下列物质的化学式K ,H ;
(2)向J的溶液中滴加2滴KSCN溶液,可观察到 ;若将一定量J的饱和溶液滴入到沸水中,反应后液体的颜色变为 ,其反应的离子方程式为: ;若再向该反应后的液体中逐滴滴入稀硫酸,直至过量,整个滴加过程中所观察到的现象是
。
(3)已知X与足量的B反应生成的E和F的物质的量之比为2:1,则X的化学式(不考虑结晶水)为: ;
(4)写出下列反应的离子方程式:
反应② ;
反应③ ;
反应⑤ 。
29、(16分)根据硫酸铜晶体结晶水含量的测定实验,填写下列空白:
(1)、此实验操作顺序如下:①称量坩埚、晶体;②加热、冷却;③称量;④ ;⑤ ;⑥计算;⑦分析实验误差。
(2)、用托盘天平称量的时候,若指针偏向左边,则表示
A左盘重,样品轻 B左盘轻,砝码重 C右盘重,样品轻 D右盘轻,样品重
(3)、在进行加热时,应该用 来夹持坩埚;为了防止硫酸铜晶体失去结晶水时不完全,同时又要防止CuSO4分解,造成实验产生误差,所以在加热操作中要:
① ;②
(4)、加热后的坩埚应放在 中冷却,如果放在空气中自然冷却,则会使实验结果 (填“偏低”、“偏高”、“无影响”)
(5)、在进行④⑤两步实验时,有时还要重复进行,这是由于
。
化学答案及评分标准
6A 、7D、 8C、 9C、 10D、 11C、 12C、 13A
26、(15分)(1)1、6、14、2、6、7(3分)
(2)由反应②可知,反应①剩余的![]() (3分)
(3分)
反应①消耗的![]() (3分)
(3分)
则![]() (3分)
(3分)
![]() (3分)
(3分)
27、(12分)(1)(每空3分)NaOH ; NH3·H2O ; Ba(NO3)2
(2)(3分) Al3+ + 3HCO3- ==Al(OH)3↓ + 3CO2↑
28.(17分) (1)(每空1分)Fe(OH)3;HCl
(2)溶液变为红色(1分);红褐色(1分),Fe3++3H2O 沸水 Fe(OH)3(胶体)+3H+ ;(2分)
先有红褐色沉淀生成(1分),后沉淀逐渐溶解(1分),得到棕黄色溶液(1分)。
(3)(NH4)2Fe(SO4)2 (2分)。
(4)(每空2分)
②2NH4++Fe2++4OH-微热2NH3↑+Fe(OH)2↓+2H2O
③Cl2+2OH-=Cl-+ClO-+H2O
⑤2Fe2++Cl2=2Fe3++2Cl-
29、(16分)(1)、④加热、冷却(2分) ⑤称量(2分) (2)、D(1分) (3)、坩埚钳(1分) ①用玻璃棒轻轻搅拌晶体(2分) ②用酒精灯缓慢加热(2分) (4)、干燥器(1分) 偏低(2分) (5)、连续两次称量相差大于0.1g 时(2分),说明晶体分解不完全因而要重复操作(1分)。