高三理科综合(化学部分)测试(1) 高三( )班 姓名 学号
选择题(每小题只有一个正确答案,每题6分,共48分)
1. 下列变化能够实现的是
①溶液中两种盐之间反应未得到两种新盐
②在溶液中,弱酸与盐反应生成强酸
③一种单质在另一种气体中燃烧,发生的反应不是化合反应
④两种非金属氧化物之间发生反应生成另一种氧化物和一种其他物质
A.①②③ B.②③④ C.①③④ D.①②③④
2. 设NA为阿伏加德罗常数。下列叙述中不正确的是
A.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为NA
B.常温常压下,0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA
C.0.25mol O2的摩尔质量为 8 g · mol-1
D.1 L 1 mol·L-1的NaHCO3溶液中离子总数大于2NA
3. 实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
![]() 。
。
反映上述有关反应的离子方程式错误的是
A.2Al+2OH—+2H2O=2AlO2—+3H2↑
B.2HCO3—+2AlO2—+H2O=2CO2↑+2Al(OH)3↓
C.NH4++AlO2—+2H2O=NH3·H2O+ Al(OH)3↓
D.3H++Al(OH)3=Al3++3H2O
4.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液
Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为—1的溶液
Na+ 、Mg2+ 、I-、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液
K+ 、CO32-、NO![]() 、Al3+
、Al3+
5. 某学生用碱式滴定管量取 0.1mol·L-1的NaOH溶液,开始时仰视液面,读数为11.0mL,
取出部分溶液后,俯视液面,读数为19.0mL,实际取出液体的体积
A.大于8 mL B.小于8 mL C.等于8 mL D.无法确定
6.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是
A.HNO3、Ba(NO3)2、NH4NO3、AgNO3
B.HNO3、NH4NO3、Ba(NO3)2、AgNO3
C.NH4NO3、HNO3、Ba(NO3)2、AgNO3
D.NH4NO3、HNO3、AgNO3、Ba(NO3)2
7.将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为
A.0.92g B.0.69g C.0.64g D.0.23g
8.某结晶水合物化学式为R·nH2O,其式量为M。 25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是
A.饱和溶液物质的量浓度为:![]() mol·L-1
mol·L-1
B.饱和溶液溶质的质量分数为:![]() %
%
C.25℃时R的溶解度为:![]() g
g
D.饱和溶液的密度为:![]() g·mL-1
g·mL-1
9.(14分)已知D是单质,其他均是常见的化合物,它们之间的转化关系如下图所示,其中
M(A)<M(B)。
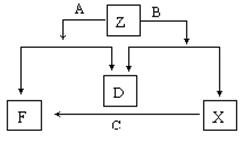
回答下列问题:
(1)符合此转化关系的A、B、D的化学式分别是:
A 、B 、D ;
(2)写出Z的电子式: , Z中阴阳离子数之比为:
(3)写出X转化为F的离子方程式:
(4)室温下,将2g苯和过量的D混合,完全燃烧,放出83.6kJ的热量,写出苯燃烧热的热化学方程式 。
10.(9分) 多硫化物S![]() (X的数值在2~6之间)在碱性溶液中被BrO
(X的数值在2~6之间)在碱性溶液中被BrO![]() 氧化为SO
氧化为SO![]() ,而BrO
,而BrO![]() 被还原为Br-,在反应中消耗BrO
被还原为Br-,在反应中消耗BrO![]() 和OH-的物质的量之比为2 : 3,则
和OH-的物质的量之比为2 : 3,则
(1)X的值为 。
(2)反应的离子方程式 。
(3)此反应的还原剂与氧化剂物质的量之比是 。
11.(16分) 某含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A、比mg多 B、比mg少 C、恰好为mg D、不能确定
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需玻璃棒、烧杯外,还需用到的玻璃仪器是: 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ;②Fe2(SO4)3 。
12.(21分) 要求写出必要的文字说明、化学方程式和重要的解题步聚,只写出最后答案不给分。
著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl, 已知NaCl、NaHCO3、NH4Cl在不同温度的溶解度如下:
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
今在40℃时,向434 g饱和食盐水中通入44.8 L(标准状况)NH3,再向溶液中通入过量的CO2,
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
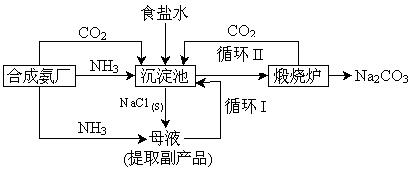
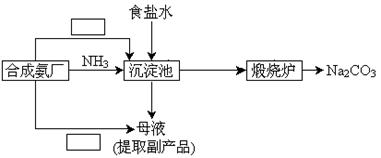
(5)某学生利用合成氨厂的原料和产物,设计了一个能充分利用各组成物质同时达到制取纯碱和回收氯化铵的实验方案。请你补充完整该学生的流程框图。
答案
9.
(1)H2O CO2 O2
(2)Na2O2 1:2
(3)CO32-+Ca2+=CaCO3↓
(4)C6H6(1)+15/2O2(g)=3H2O(l)+6CO2(g);△H=-3260.4kJ/mol
10.
(1)5
(2)3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O
(3)3:16
11.
(1)B
(2)抑制Fe2+、Fe3+的水解
(3)250mL的容量瓶、胶头滴管
(4)2Fe2++Br2=2Fe3++ 2Br-
(5)7(W2-W1)/m
(6)①不变②偏高
12.根据40℃时NaCl的溶解度,可以计算出434 g食盐水中NaCl的质量和物质的量:![]() ,
,![]()
通入的NH3的物质的量:![]() (3分)
(3分)
由反应式NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl可知各反应物和生成物之间物质的量相等的关系。
所以,可生成NaHCO3的质量:m(NaHCO3)=2 mol×84 g·mol—1=168 g
溶液中剩余的水的质量为:![]()
这些水在40℃时可溶解NaHCO3的质量:![]()
(1)析出NaHCO3的质量为:m(NaHCO3)=168 g—36.5 g=131.5 g (4分)
(2)现有NH4Cl质量:m(NH4Cl)=2 mol×53.5 g·mol—1=107 g
40℃时,280.8 g水中可溶NH4Cl质量:
![]()
因为129.17 g >107 g,所以NH4Cl不能析出。 (4分)
(3)降温至10℃,可析出NH4Cl
![]() (4分)
(4分)
(4)降温至10℃时,NH4Cl溶液已饱和,可加入NaCl粉末,搅拌使之溶解,从而增加
Cl — 浓度,使NH4Cl的如下溶解平衡向左移动,则可析出更多的NH4Cl晶体。
![]() ,或继续通氨气,增加NH4+浓度,使NH4Cl的溶解平衡向左移动 (3分)
,或继续通氨气,增加NH4+浓度,使NH4Cl的溶解平衡向左移动 (3分)
(5)CO2、NH3正确(1分),循环Ⅰ(1分)、Ⅱ(1分)