高三理综测试化学部分试题
一、选择题(每小题一个正确答案,每题6分)
1、将1molCH4与Cl2发生取代反应,待反应完全后,测得四种含碳取代物的物质的量相同,则消耗的Cl2为: ( C )
A 0.5mol B 2mol C 2.5mol D 4mol
2、分子式为C8H16O2的有机物A,能在酸性条件下水解生成有机物B和C,且C在一定条件下氧化成B,则有机物A的可能结构有 (A)
A 2种 B 3种 C 4种 D 5种
3、下列离子方程式改写为化学方程式正确的是 (D)
A Mg2++2OH-==Mg(OH)2↓
MgCO3+2NaOH== Mg(OH)2↓+Na2CO3
B Ba2++SO42-==BaSO4↓
Ba(OH)2+NaHSO4== BaSO4↓+NaOH+H2O
C Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
Ca(OH)2+2NaHCO3== CaCO3↓+2H2O+Na2CO3
D S2-+Cu2+==CuS↓
Na2S+CuSO4== CuS↓+Na2SO4
4、α-AgI是一种固体导体,导电率很高。为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,![]() 下列有关结论正确的是
(B)
下列有关结论正确的是
(B)
A 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀
B 若α-AgI是Ag+导电则通电一段时间后晶体密度仍均匀
C 不管α-AgI是I-导电还是Ag+导电,则通电一段时间后晶体密度均有变化
D 若α-AgI是I-导电则通电一段时间后晶体密度不均匀
5、短周期元素X和Y,X元素位于Y元素的前一周期,其原子最外层电子层只有一个电子,Y原子的次外层电子数是最外层电子数的1/3,则X和Y形成的化合物的化学式可表示为
A X2Y B X3Y C XY2 D X2Y3 (A)
6、新型绿色电池是指容量大、环境污染小的化学电池。锂电池是近年发展起来的一种新型绿色电池,在通迅、医辽上具有广泛的应用。其电池的总反应式为8Li+3SOCl2==6LiCl+Li2SO4+Li2SO3+2S则下列说法不正确的是 (D)
A 负极反应为:8Li-8e-==8Li+
B 正极材料可选用多孔隙的石墨材料
C 正极反应为:3SOCl2+8e-==SO32-+2S+6Cl-
D 电池工作时,电流经外电路由负极到正极
7、下列各组离子在溶液中能大量共存的是 (C)
A K+、NH4+、HSO3-、OH-
B H+、Fe2+、SO42-、NO3-
C Na+、OH-、SO32-、AlO2-
D Na+、H+、Cl-、C6H5O-
8、铜和镁的合金4.6克完全溶解于浓硫酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mLN2O4气体(已折算到标准状态),在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀的质量为 (B)
A 9.02g B 8.51g C 8.26g D 7.04g
二、非选择部分
9、0.1 mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后,生成的二氧化碳完全被300 mL 2 mol·L—1的氢氧化钠溶液吸收。所得溶液中含有两种物质的量相等的溶质。
(1)若为纯净物,试推断符合条件烯烃可能有的分子式:
① ;② ;③ 。(可以不填满,也可以补充)
(2)若为两种烯烃的混合物,试推断符合条件可能的组成及体积比(可以不填满,也可以补充)
| 序 号 | 组 成 | 体积比 |
| 1 | ||
| 2 | ||
| 3 |
(1)C4H8;(2)①C2H4和C5H10体积比1:2 ②C3H6和C5H10体积比1:1
10、SO2和CO2一样是一种酸性氧化物,也具有下列性质:
SO2(少量)+Ca(OH)2==CaSO3↓(白色)
CaSO3+SO2+H2O==Ca(HSO3)2(溶于水)。
某同学为了验证SO2也具有上述性质,将SO2通入到澄清的石灰水中,却发现没有看到有沉淀生成再溶解的过程。经过一番思考,该同学想到了两个原因。
(1)如果你做这个实验,你认为看不到上述现象的原因是:
、 。
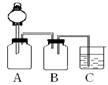 该同学认为问题的的关键在于SO2的通入速率太快,他重新设计了实验,使实验圆满成功。实验装置如下:
该同学认为问题的的关键在于SO2的通入速率太快,他重新设计了实验,使实验圆满成功。实验装置如下:
其中A是贮气瓶,里边盛放有SO2气体,通过分液漏斗控制液滴的下滴速度,来达到控制SO2的流速的目的。
(2)分液漏斗中盛放的液体最好是:
A 饱和的NaCl溶液 B H2O C 稀盐酸 D 饱和的NaHSO3
(3)B装置的名称是 ,所起的作用是 。
(4)C装置中为了能够明显观察到石灰水由混浊到澄清的现象,该同学还加入了适量的NaOH,它的作用是 。
(5)该同学实验设计的欠缺之处在于 。
(1)SO2的溶解性大,在溶液中的浓度大,有更多的H2SO3生成。
H2SO3的酸性更强,极易使Ca(OH)2转化成Ca(HCO3)2。
(2)D
(3)安全瓶 防止液体倒吸
(4)和SO2反应生成SO32-,有利于看到白色沉淀。
(5)缺少一个尾气吸收的装置。SO2对空气有污染。
11、维生素C又名抗坏血酸,可预防感染、坏血症等,也是一种常见的食品添加剂,能阻止空气中的氧气将食品氧化变质。维生素C的工业合成路线如下:
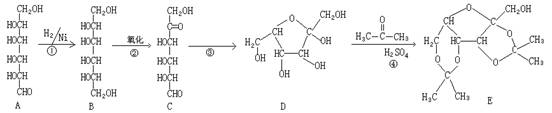
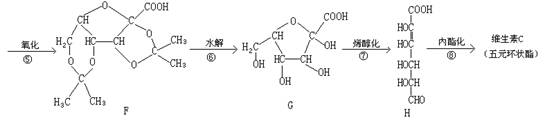
(1)上述合成过程中与A互为同分异构体的有 (填写字母代号,下同)。
(2)上述反应中,属于加成反应的有 (填数字序号)
(3)反应④除了生成E外,还有 生成。比较D和G的结构可知,G可看作是由D通过反应⑤氧化得到,那么在工业上设计④和⑥两步的目的是
(4)维生素C的结构简式是
(5)苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加维生素C则可有效防止这种现象的发生。这说明维生素C具有
A 氧化性 B 还原性 C 碱性 D 酸性
(6)从维生素C的结构来看,它的官能团有 种
A 2 B 3 C 4
(1)C D(2)①③ (3)H2O 保护D分子羟基不被氧化 (4)![]() (5)B(6)B
(5)B(6)B
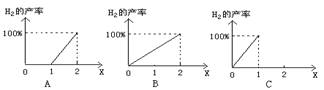
12、发生炉煤气是城市管道煤气中的一种重要气源,它的生要成分是CO,但由于CO有毒,所以煤气厂技术人员利用以下反应,将部分CO转换成H2:CO+H2O(g)![]() CO2+H2
CO2+H2
(1)在一定条件下,上述反应达到平衡,则混合物中碳的氧化物中碳、氧元素的质量比可能是 (C)
A 3:1 B 3:4 C 3:5 D 3:8
(2)设CO的转化率为75%,则碳的氧化物中m(C):m(O)为 (3:7)
(3)现用COx表示平衡混合物中的碳的氧化物的组成,则表示x与反应CO+H2O(g)![]() CO2+H2中H2产率关系正确的是
(A)
CO2+H2中H2产率关系正确的是
(A)