高三理综考前全真模拟化学卷
第Ⅰ卷
6.“水华”现象是一种水污染的表现,形成“水华”的主要原因是水体富营养化,水草过度生长。为减少“水华”现象的发生,人们可采取的措施是( )
A、使用高毒性除草剂 B、使用无磷洗涤剂
C、把工业废水直接排放 D、水中多养鱼
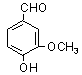 |
7.香兰素结构简式为 ,它有宜人的气味,存在于香草、安息
香和香茅油中,是制作 巧克力的辅助原料,下列关于香兰素的叙述不正确的是( )
A、香兰素的分子式是C8H8O3 B、它可以和NaOH溶液反应
C、它可以发生银镜反应 D、它可以发生水解反应
8.下列反应的离子方程式书写正确的是( )
A、用氨水吸收少量SO2气体 2NH3·H2O+SO2=2NH4++SO32-+H2O
B、向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化
2Fe2++Cl2=2Fe3++2Cl-
C、NH4HCO3溶液与过量的NaOH溶液共热
![]() NH4++OH-=NH3↑+H2O
NH4++OH-=NH3↑+H2O
D、Cl2通入水中 Cl2+H2O=2H++Cl-+ClO-
9.某无色气体可能由CH4、NO2、NH3、H2、CO、CO2和HCl中的几种气体组合而成,在恒温恒压下,将此混合气体通过过量的澄清石灰水,未见石灰水变浑浊,但混合气体的总体积减少;将剩余气体导出后,在氧气中点燃,燃烧产物不能使无水CuSO4粉未变蓝色,则原混合气体( )
A、一定不含CH4和H2,可能含有NO2和NH3
B、一定含有CO,可能含有HCl和CO2
C、只含有CO和HCl D、一定含有CO和HCl,可能含CO2
10.下列产物有关实验中,用所选用的试剂(括号内物质)不能达到目的的是( )
A、检验Na2SO4溶液中是否混有NaCl(AgNO3溶液)
B、证明FeCl2溶液被氧化(KSCN溶液)
C、除去C2H2气体中的H2S气体(CuSO4溶液)
D、鉴别SO2和CO2两种气体(溴水)
11.向NaBr、NaI、Na2SO3的混合溶液中,通入一定量的Cl2后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A、Na2SO4、NaCl、I2 B、NaCl、Na2SO4、NaBr
C、Na2SO3、NaBr、NaCl D、Na2SO4、NaCl、NaI
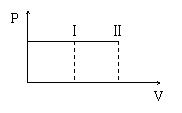 12.一带有活塞的密封容器中盛有A、B组成
12.一带有活塞的密封容器中盛有A、B组成
的混合气体,在通常条件下,从状态Ⅰ反应
到状态Ⅱ时,气体体积(V)与气体压强(P)
的变化曲线如图所示。则反应A(g)+B(g)=2C(g) ( )
A、是放热反应 B、反应后气体总分子数增多
C、是吸热反应
D、反应物具有的总能量等于生成物具有的总能量
13.将0.4mol·L-1的NH4NO3溶液VL与0.2mol·L-1的NaOH溶液VL混合后,溶液中除NO3-外,下列粒子的浓度关系正确的是( )
A、C(NH4+)>C(Na+)=C(OH-)>C(NH3·H2O)
B、C(NH4+)=C(Na+)>C(NH3·H2O)>C(OH-)
C、C(NH4+)=C(Na+)>C(OH-)>C(NH3·H2O)
D、C(NH4+)>C(Na+)>C(NH3·H2O)>C(OH-)
第Ⅱ卷
26.(16分)甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系:(反应中生成的水已略去)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
⑴丙的名称是________________;C的化学式是________________;X属____________晶体。
⑵A+D→C的反应属于下列何种反应类型(填序号)_____________。
A、化合反应 B、氧化还原反应 C、非氧化还原反应 D、离子反应
⑶工业生产中,将D转化为E的反应条件是__________________________。
⑷写出A与H2O反应的化学方程式
_________________________________________________________________
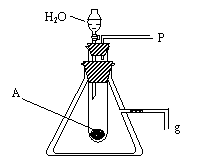 ⑸若用如图装置来证明A和H2O的反应:①是放热反应 ②生成了丙。简单合理的实验操作是:
⑸若用如图装置来证明A和H2O的反应:①是放热反应 ②生成了丙。简单合理的实验操作是:
①_________________________________
_____________________________________
_____________________________________
②_________________________________
_____________________________________
_____________________________________
27.(18分)⑴A+、B+、C-、D、E代表5种微粒(分子或离子),它们分别含10个电子,已知它们有如下转化关系:A++C-=D+E;B++C-=2D
①A+的电子式为____________;E分子的空间构型为______________。
②C-、D、E这3种微粒结合质子(H+)的能力由强到弱的顺序为(用微粒的化学式表示)__________________;其理由是(用两个离子方程式表示)____________________________________________________________。
⑵某厂废水中含KCN浓度为650mg/L,现用氯氧化法进行处理,防止剧毒的CN-污染水源。
①液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一)反应如下:(其中N均为-3价)
KSN+2KOH+Cl2=KCNO+2KCl+H2O,则被氧化的元素为___________。
②投入过量的液氯,氰酸盐可进一步氧化为氮气,配平下列化学方程式,并标出电子转移的方向和数目。
| |
| |
| |
| |
| |
| |
| |
③若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯_________g。
28.(14分)取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,再分别稀释为100mL
⑴在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:①__
____________②_______________③______________④_________________
|
|
|
|
|
|
|
|

0.1mol/L的盐酸,产生CO2的体
积(标准状况)与所加盐酸的体积
关系如图所示:
①分别加入足量的盐酸后,溶液中的溶质是_______________,原NaOH溶液的物质的量浓度为__________________mol/L。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是_____________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为____________,其物质的量之比为____________________。
29.(12分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
⑴将固体NaCl细粒干燥后,准确标出m克NaCl固体并转移到定容仪器A中。
⑵用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤⑴中A仪器最好使用_________________________。(填序号)
A、量筒 B、烧杯 C、容量瓶 D、试管
②步骤⑵中应用_________________(酸式或碱式)滴定管,因为_____
_______________________________________________________________。
③该实验中不能用水代替苯,是因为_____________________________。
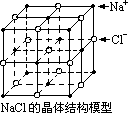 ④已知NaCl晶体如图所示,X射线
④已知NaCl晶体如图所示,X射线
测得NaCl晶体中靠得最近的Na+和
Cl-间的平均距离为a cm,用上述
方法测得的阿伏加德罗常数NA的表
达式为__________________________
理综模拟考试化学卷答案
第Ⅰ卷选择题(6×8=48分)
6、B 7、D 8、A 9、A 10、A 11、B 12、A 13、D
第Ⅱ卷
26、(每空2分,共16分)
(1) 氧气;Na2SO4;离子。
(2) A、B。
(3) 400℃-500℃,催化剂。
(4) 2Na2O2+2H2O=4NaOH+O2↑
(5) ①将导管口插入水面下,打开分液漏斗活塞,反应后,q导管口有气泡冒出,则证明反应
(6) ②打开分液漏斗,使之反应。然后用带火星的木条置于p管口,木条复燃则证明有氧气生成。
27、(每空2分,共18分)
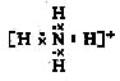 (1)①
(1)①
;三角锥形。
②OH->NH3>H2O;OH-+NH4+=NH3↑+H2O;NH3+H3O+=NH4++H2O
(2)①碳元素②2KCNO+4KOH+3Cl2=2CO2+N2+6KCl+2H2O
③35.5
28、(14分)(1)①NaOH、Na2CO3②Na2CO3③Na2CO3、NaHCO3④NaHCO3(每空1分)
(2)①NaCl;a15(各2分)②33.6(2分)③Na2CO3和NaHCO3;1:1(各2分)
29、(12分)
(1)C(2)酸式;碱式测定管上的橡胶管被苯浸泡易损坏变形(3)NaCl易溶于水,那样会测不准固体NaCl的体积(以上每空2分)
![]() (4)
(4)