高三摸底考试化学试卷
YCY
本试卷第I卷(选择题)和第II卷(非选择题)两部分。共100分。考试时间90分钟。
第I卷(选择题,共46分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32
Cl 35.5 K 39 Mn 55
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了防止仲秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是 ( )
A.生石灰 B.还原铁粉 C.亚硫酸钠 D.维生素C
2.下列关于氯气或氯元素的叙述中,正确的是 ( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在氯气中燃烧,生成棕黄色固体CuCl2
C.有氯气参加的化学反应必须在溶液中进行
D.氯元素有毒,应禁入口中
3.下列物质中,本身属于非电解质,但溶于水后的生成物属于电解质的是 ( )
A.氧化钠 B.氯化氢 C.三氧化硫 D.乙醇
4.下列变化,需加入还原剂才能实现的是 ( )
A.Br-→Br2 B.NO![]() →NO C.SiO2→SiO
→NO C.SiO2→SiO![]() D.Fe→Fe3O4
D.Fe→Fe3O4
5.在粗碘中含有IBr和ICl,受热时,I2、ICl、IBr均可升华。在粗碘中加入一种物质后,再进行升华,可制得精碘,应加入的物质是 ( )
A.KI B.Zn C.KCl D.H2O
二、选择题(本题包括12小题,每小题3分,共36分。每小题只有一个选项符合题意)
6.每年元宵节晚上,我市都要举行盛大的焰火庆祝活动。焰火绽放出的五颜六色是一些金属离子魅力的展示。焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝金属粉末等添加剂。下列说法正确的是 ( )
A.碳酸铜因为受热分解才发出绿色的光
B.氯酸钾的主要用途是产生紫色的焰火
C.镁铝在焰火中发出耀眼的白光
D.黑火药的主要成分是木炭、硫磺
7.对锂的结构和性质的判断,错误的是 ( )
①与水反应比钠剧烈 ②它的原子半径比钠小
③它的氧化物暴露于空气中易吸收水分 ④它的单质可做还原剂
⑤它的阳离子的最外层电子数与钠离子的最外层电子数相同
A.只有① B.③和④ C.②和③ D.①和⑤
8.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.在标准状况下,VL水含有的氧原子个数为![]() NA
NA
B.常温下,2L 1 mol·L-1的甲酸溶液中,所含分子总数小于2NA
C.1 mol FeCl3跟水完全反应转化为氢氧化铁胶制后,其中胶体粒子的数目为NA
D.1 molNH![]() 中含电子数为 10NA
中含电子数为 10NA
9.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是 ( )
A.硫酸铜的溶解度 B.溶液中溶质的质量分数
C.溶液的质量 D.溶液中Cu2+的数目
10.在实验室中配制一定物质的量浓度溶液的有关操作中,正确的是 ( )
A.配制0.1mol·L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量
B.配制0.1mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
C.配制0.1mol·L-1的NaCl溶液时,最后用胶头滴管加水至刻度线
D.配制0.1mol·L-1的HCl溶液时,要将量取浓盐酸的量筒和溶解用的烧杯洗涤2—3次,并将洗涤液转入容量瓶中
11.在标准状况下,ag气体A与bg气体B的分子数相同,则与此有关的以下说法中不正确的是 ( )
A.气体A与气体B的摩尔质量之比为a:b
B.相同状况下,同体积的气体A与气体B的质量之比为a:b
C.质量相同的气体A与气体B的分子数之比为b:a
D.同温同压下,气体A与气体B的密度之比为b:a
12.下列各组物质以任意量在溶液中反应时,始终能用同一离子方程式表示的是 ( )
A.Aa(HCO3)2溶液和Ca(OH)2溶液
B.NaHCO3溶液和Ca(OH)2溶液
C.Na2CO3溶液和稀盐酸
D.FeBr2溶液和氯水
13.有一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色,再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液中可能大量共存的一组离子是 ( )
A.K+、H+、NO![]() 、Na+ B.H+、Br-、SO
、Na+ B.H+、Br-、SO![]() 、Na+
、Na+
C.SO![]() 、Br-、OH-、Fe3+ D.H+、Br-、SO
、Br-、OH-、Fe3+ D.H+、Br-、SO![]() 、K+
、K+
14.制备氰氨基化钙的化学方程式如下:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,关于该反应的下列说法,正确的是 ( )
A.氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是还原产物,H2是氧化产物
D.CO为氧化产物,H2为还原产物
15.物质的量均为1 mol的下述物质,长期放置于空气中(不考虑潮解情况),最后质量增加的大小关系是 ( )
①氧化钠 ②过氧化钠 ③氢氧化钠 ④亚硫酸钠
A.①=③>②>④ B.①>②>④>③
C.③>①=②>④ D.④>③>②>①
16.在100g浓度为18mol·L-1、密度为![]() cm-3的浓硫酸中加入一定量的水,稀释成
cm-3的浓硫酸中加入一定量的水,稀释成
9mol·L-1的硫酸,则加入水的体积为 ( )
A.小于100mL B.等于100mL
C.大于100mL D.等于![]() mL
mL
17.使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为 ( )
A.8.8g B.6.4g C.8.2g D.6.2g
第Ⅱ卷(非选择题,共54分)
|
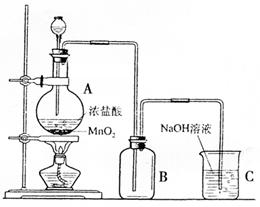
18.(8分)右图是某同学在实验室中制取
Cl2的装置图:
(1)该装置中的错误之处有二,分别是:
①
②
(2)试写出装置A和C中发生反应的离
子方程式:
A处: ;
C处: 。
(3)甲、乙两同学分别采用下列两种方案制取Cl2。
甲:用含HCl 146 g的浓盐酸与足量的MnO2反应;乙:用87 g MnO2与足量浓盐酸反应,则所得氯气 (填代号)。
A.甲比乙多 B.乙比甲多 C.一样多 D.无法比较
|
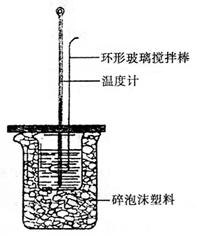
步骤如下:
①用一个量筒量取50mL 0.5mol·L-1的盐酸,倒入
小烧杯中,并用温度计测量盐酸的温度(均读准至
0.1℃,下同),记入表格;
②用另一个量筒量取50mL 0.55mol·L-1的NaOH溶
液,并用温度计测量氢氧化钠溶液的温度,记入表
格;
③在两个烧杯之间填满碎泡沫,并使杯口相平;盖板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过;
④把量筒中的氢氧化钠溶液倒入小烧杯中,并立即把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,用玻璃搅拌棒轻轻搅动溶液,准确读取混合溶液的温度,记入表格。
再重复实验两次,所得数据如下:
| 实验编号 | 起始温度t1/℃ | 终止温度 (t2/℃) | 温度差 (t2-t1)/℃ | ||
| 盐酸 | 氢氧化钠溶液 | 平均值 | |||
| 1 | 20.0 | 20.0 | 20.0 | 23.4 | 3.4 |
| 2 | 20.0 | 20.0 | 20.0 | 23.4 | 3.4 |
| 3 | 20.0 | 20.0 | 20.0 | 21.6 | 1.6 |
回答下列问题:
(1)实验步骤的先后顺序为(填编号) 。
(2)步骤①、②中都使用了温度计,若使用同一支温度计,应注意的问题是
。
(3)试根据上述数据计算中和热[盐酸和氢氧化钠溶液的密度近似为1g/cm3,反应后溶液的比热容近似为4.18J/(g·℃)],并据此写出该反应的热化学方程式
。
(4)下列操作能够减少实验误差的是 (填代号)。
A.用保温杯代替烧杯
B.步骤②中的氢氧化钠溶液分多次倒入小烧杯中
C.步骤④中读取混合溶液的最高温度作为终止温度
D.其它数据不变,把50mL的盐酸和氢氧化钠溶液都改为5mL
E.其它数据不变,把盐酸和氢氧化钠溶液的浓度都增加10倍
(5)若将盐酸和氢氧化钠溶液分别改为醋酸和氨水,其它数据不变,则测得的中和热与上述实验测得的中和热比较 (填偏大、偏小或相同),原因是
。
四、(本题包括3小题,共20分)
20.(4分)(1)在品红溶液中加入新制的氢氧化铝,溶液红色褪去,其褪色原理与下列中的
(填代号)物质相同。
A.活性炭 B.SO2 C.氯水
(2)少量Na2O2投入水中,待反应后再滴入品红溶液,红色褪去,说明溶液中存在
(填化学式),其褪色原理与上述(1)中的原理 (填相同
或不相同)。
21.(7分)(1)配平下列氧化还原方程式:
FeSO4+ KNO3+ ( )= K2SO4+ Fe2(SO4)3+ NO+ H2O
(2)A、B、C、D是原子序数小于20的四种元素,A与B同主族且能形成AB2型分子,A、C、D所形成的简单离子具有相同的核外电子排布,且离子半径依次减小。请回答:
①证明某化合物中含有D元素采用的实验方法为 ,现象是 。
②写出C的单质通入AB2的水溶液中所发生反应的离子方程式:
。
22.(9分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH![]() 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO![]() 、NO
、NO![]() 、OH-、CO
、OH-、CO![]() 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是
。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式
。
五、(本题包括2小题,共15分)
23.(3分)标准状况下,1体积水可以溶解700体积氨气,所得溶液的密度为0.90g·mL-1,则该氨水的物质的量浓度为 。
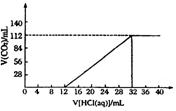
24.(12分)现有某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物6.14g,加水溶解后,所取得溶液的十分之一,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗稀盐酸的体积,得到如下图所示的曲线,试计算:
|
(2)原混合物中两种盐的物质的量之比。
(3)所滴加盐酸的物质的量浓度。
(4)确定此两种盐的化学式。
参考答案
一、(2分×5=10分)
1.A 2.B 3.C 4.B 5.A
二、(3分×12=36分)
6.C 7.D 8.D 9.B 10.C 11.D 12.A 13.B 14.B 15.B 16.A 17.C
三、(共19分)
|
(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Cl2+2OH-=Cl-+ClO-+H2O(每式2分,共4分)
(3)B(2分)
19.(11分)(1)③①②④ (2分,错一处即不得分)
(2)在第一次使用温度计后,用相同温度的蒸馏水将其冼净(2分)
(3)NaOH(aq)+HCl(aq)=Na(aq)+H2O(1);△H=-56.8kJ/mol(2分)
(4)AC(2分)
(5)偏小;中和过程中,醋酸和一水合氨不断电离,吸收热量,导致实验结果偏小。(3分)
四、(共20分)
20.(4分)(1)A(1分) (2)H2O2(2分); 不相同(1分)
21.(7分)(1)6 2 4 H2SO4 1 3 2 4(2分)
(2)①焰色反应(1分),透过蓝色钴玻璃观察到紫色火焰(2分)
②Cl2+H2SO3=4H++SO![]() +2Cl-(2分)
+2Cl-(2分)
22.(9分)(1)(NH4)2CO3(1分);D和A、B都能生成气体,而题给离子中只有H-与CO![]() 、OH-与NH
、OH-与NH![]() 能反应生成气体,故D只能为(NH4)2CO3(2分)
能反应生成气体,故D只能为(NH4)2CO3(2分)
(2)A.H2SO4 B.NaOH C.Ba(NO3)2 (每空1分,共3分)
(3)NH![]() +OH-=NH3↑+H2O NH3+H+=NH
+OH-=NH3↑+H2O NH3+H+=NH![]() (3分,错一个扣2分,扣完为止)
(3分,错一个扣2分,扣完为止)
五、(共15分)
23.(3分)18.37mol·L-1(3分)
24.(12分)
解:(1)原混合物中n(C)=10n(CO2)=![]() =0.05mol
=0.05mol
m(C)=0.05mol×12g/mol=0.6g
![]() (C)=
(C)=![]() ×100%=9.77%(3分)
×100%=9.77%(3分)
(2)设两种盐的化学式分别为M2CO3和MHCO3,逐滴加入盐酸时所发生的反应为
M2CO3+HCl=MHCO3+MCl
MHCO3+HCl=MCl+CO2↑+H2O
由图象知与混合物中M2CO3反应生成MHCO3所消耗盐酸的体积为12mL,与原混合物中MHCO3反应消耗的盐酸体积为(32-12×2)mL=8mL。又由上述反应方程式可知,1mol M2CO3与盐酸反应生成1 mol MHCO3,则原混合物中正盐与酸式盐的物质的量之比为n(M2CO3): n(MHCO3)=12 : 8=3 : 2(4分)
(3)设原混合物中M2CO3和MHCO3的物质的量分别为x和y
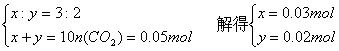
又由0.03mol M2CO3消耗0.012L×10=0.12L稀盐酸生成MHCO3,可得
x=0.12L·c(H+) 即0.03mol=0.12L·c(H+)
解得c(H+)=![]() =0.25mol·L-1(3分)
=0.25mol·L-1(3分)
(4)设M的相对原子质量为M,则
0.03×(60+2M)+0.02×(61+M)=6.14 解得M=39 即为钾元素
这两种盐的化学式为K2CO3、KHCO3 (2分)
(其他解法正确同样给分)