高三年级第二次调查测试化学试题
化 学 试 题
第Ⅰ卷(选择题 共72分)
可能用到的相对原子质量: H 1 D 2 Cl 2 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32 Cl 35.5
K 39 Ca 40 Fe 56 Cu 64 Zn 65
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.保护环境,实现可持续发展是全人类的共识。下列各项举措中,主要是为了保护大气臭氧层的是
A.实现无氰电镀 B.使用无氟冰箱
C.使用无铅汽油 D.研发可降解塑料
2.下列各组中的两种微粒,所含有的电子数不相等的是
A.Na+、Mg2+ B.F-、OH-
C.NH4+、—OH D.CH4、H2O
3.遇有下列情况,及时处理有误的是
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C. 金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
4.下列物质的分离、提纯和鉴别的方法中(必要时可加热),可行的是
A.以AgNO3溶液和稀盐酸检验溶液中是否含有Cl-
B.用升华法分离碘和氯化铵的混合物
C.以粗铜为阴极,精铜为阳极,CuSO4溶液为电解液,精炼铜
D.用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+
5.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是
A.Q1<Q3<Q2 B.Ql<Q2<Q3
C.Q1<Q2=Q3 D.Q1=Q2=Q3
6.关于制取硝酸铜的以下三种方案(原理)的叙述中,正确的是:
①2Cu+O2![]() 2CuO,
CuO+2HNO3=Cu(NO3)2+H2O;
2CuO,
CuO+2HNO3=Cu(NO3)2+H2O;
②3Cu+8HNO3(稀)![]() 3Cu(NO3)2+2NO↑+4H2O;
3Cu(NO3)2+2NO↑+4H2O;
③Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
A.三方案中所涉及的反应都属于氧化还原反应
B.三方案中硝酸的利用率②>①>③
C.制取相同量的硝酸铜②产生的有害气体比③多
D.三种方案中①方案最优
7.某元素R在其氢氧化物和硝酸盐中的化合价均为+n,若上述两化合物的式量分别为M、N,则n为
A.(N-M)/45 B.(M-N)/45
C.(M-N)/90 D.(N-M)/90
8.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是:①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④
C.只有②③④ D.有①②③④
二、选择题(本题包括10小题。每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项。多选时。该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分。但只要选错一个,该小题就为0分。)
9.某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水,得v mL饱和
溶液,测得该溶液的密度为ρg/cm3,其中n(A-)为b mol。下列叙述中,错误的是
A.溶液中c(H+)=[1000b+c(OH-)V]/V mol/L
B.物质的量浓度c(HA)=1000a/MV mol/L
C.t℃时,HA的溶解度S=100a/ρV g
D.HA的质量分数ω(HA)=(a/ρV)×100%
10.共价键的断裂有均裂和异裂两种方式,即:A∶B → A·+B· ,均裂:A∶B → A++[∶B]-,异裂。下列化学反应中发生共价键均裂的是
A.2K+2H2O=2KOH+H2↑
B.2Na+2C2H5OH → 2C2H5ONa+H2↑
C.Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
D.CH3COOH+C2H5OH ![]() H2O+CH3COOC2H5
H2O+CH3COOC2H5
11.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正
确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
12.下列无色澄清的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Na+、AlO2-、Cl-
13.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
14.能正确表示下列反应的离子方程式或电极反应式的是
A.碳酸钠和碳酸氢钠的混合溶液中滴加少量稀硫酸:HCO3-+H+=CO2↑+H2O
B.漂白粉溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C.苯酚钠溶液中通入过量的二氧化碳:2C6H5O-+CO2+H2O → 2C6H5OH+CO32-
D.工业上电解饱和食盐水,阳极电极反应式:2Cl――2e-=Cl2↑
15.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.1 mol Na2O2与足量的水反应,转移的电子数为2NA
C.标准状况下,22.4 L NO2气体中的分子数约为NA
D.常温常压下,3l g白磷分子中的共价键数为6NA
16.恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:2A(g)
![]() B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=1,则p>a B.若x=2,则p<a
C.若x=3,则p=a D.若x=4,则p≥a
17.工业上将苯蒸气通过赤热的铁合成一种传热载体化合物,其分子中苯环上的一氯取代物有3种,1 mol该化合物催化加氢时最多消耗6 mol H2,则该传热载体化合物的结构简式是
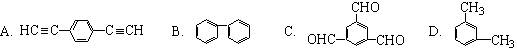 |
18.有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
◇请将第Ⅰ卷的答案填入下表:
| 题号 | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(非选择题共78分)
三、(本题包括2小题。共22分)
19.(7分)(1)实验室现有蒸馏水、稀氨水、KNO3溶液、稀H2SO4和浓HNO3。请说明你如何从上述药品中选用试剂,通过必要的操作,将内壁附有银镜的试管洗涤干净。
(2)下列操作会导致实验值较实际值(或要求值)偏低(或偏小)的是__________ (填代号)。
A.测定硫酸铜晶体中结晶水含量时,将加热后的坩埚(内盛药品)置于干燥器中冷却后再称量
B.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
C.酸碱中和滴定实验中,将待测NaOH溶液装于碱式滴定管,标准HCl溶液盛于锥形瓶(以酚酞作指示剂),进行滴定
D.配制100 mL2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
20.(15分)校办厂漂白车间需22.4
L(标准状况)SO2。化学小组同学依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回。
(1)化学小组所制得的气体中混有的主要杂质气体可能是_____________(填分子式)。产生这种结果的主要原因是_________________________________________________________。
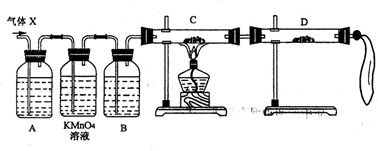 (2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收)。
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收)。
①组装好仪器后,盛放药品前,必要的一个操作是__________________________。
②A中加入的试剂可能是:___________,作用是:_____________________________。
B中加入的试剂可能是:_________________,作用是:____________________________。
③可证实气体x中混有较多量某杂质气体的实验现象是:
C中:_______________________________,D中:________________________________。
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为________________ (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四、(本题包括2小题,共18分)
21.(6分)25℃时,水的离子积为10-14;100℃时,水的离子积为10-12。若在100℃时,将pH=11的NaOH溶液a L与pH=l的H2SO4溶液b L混合,请填空:
(1)100℃比25℃时水的离子积较大的原因是:______________________________________ _____________________________________________________________________________
(2)若所得溶液为中性,则a∶b=_______;若所得混合溶液的pH=2,则a∶b=_______
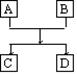 22、(2分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
22、(2分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
(1)若A、D的组成元素同主族:
①B是水:__________________________________________。
②B、C均为氧化物(反应有重要的工业价值):
____________________________________________,工业价值是:_________________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:__________________________________________;
B是水且水是氧化剂(反应有重要的工业价值):
____________________________________________,工业价值是:_________________。
②B、C均为氧化物:____________________________________________。
五、(本题包括2小题,共18分)
23.(9分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为_________________________________________________。
(2)一个A的分子中应有________个(选填2、3、4)氧原子,作出此判断的理由是:_______ _____________________________________________________________________________ _______________________________________________。A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:______________________________________(任写一种)。
 |
24.(9分)请认真阅读和领会下列有关反应的信息:试根据上述信息,按以下途径从某烃A合成一种外科药剂的中间体X(部分试剂和反应条件已略去)。
试根据上述上述信息,按以下途径从某烃A合成一种外科药剂的中间体X(部分试剂和反应条件已略去)。
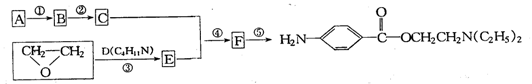 |
(1)写出A和D的结构简式:A:_________________;D:__________________。
(2)反应①~④中,属于取代反应的是:__________,反应⑤的类型为________反应。
(3)反应①和②的顺序是否可以颠倒,其理由是_____________________________________。
(4)写出反应④的化学方程式:
____________________________________________________________________________
六、(本题包括2小题,共20分)
25.(8分)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理回答下列各小题:
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有__________种。
②若m(A)为定值,生成气体的量即为定值,则A的可能组成是(填写化学式):
________、________;________、________;________、________。(可以不填满)。
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0 g,则n(A)=_________mol。
26.(12分)将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO+2NaOH=2NaNO+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围。
高三年级第二次调查测试
化学试题参考答案及评分标准
一、二、选择(4分×18=72分)
| 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | C | D | D | A | D | A | A | C | D | C | A | B | BD | AC | BC | B | BC |
三、(本题包括2小题,共22分。)
19、(7分) ⑴向试管内注入适量稀H2SO4,再加入适量的KNO3溶液,待银溶解后,倾倒出试管中溶液,再以蒸馏水洗涤至倾倒洗涤液时既不成股流下,也不附着水滴。(3分)
或:先将浓HNO3以蒸馏水稀释成稀HNO3,其它操作同上,同样给分。
注:若直接以浓HNO3除Ag后用蒸馏水洗涤达要求的给2分。
⑵BD(4分)(只选1个且正确给2分,只要错选1个即为0分。)
20、(15分) ⑴H2(1分),随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2(2分)。
(2)①检查装置气密性(1分),②品红试液,确认SO2存在;浓H2SO4,干燥氢气(每空1分,共4分),③黑色CuO粉末变红色(2分),无水硫酸铜变蓝色(2分)
四、(本题包括2小题,共18分。)
21、(6分)(1)水的电离是吸热过程,温度升高,水的电离平衡右移(2分),
⑵1∶1(2分),9∶11(2分),
22、(12分)(1)①2Na+2H2O=2Na++2OH-+H2↑(2分)(写化学方程式得1分)
②2C+SiO2![]() Si+2CO↑(2分),生产粗硅(1分),
Si+2CO↑(2分),生产粗硅(1分),
⑵①2F2+2H2O=4HF+O2(2分),C+H2O![]() CO+H2(2分),生产水煤气(1分),
CO+H2(2分),生产水煤气(1分),
②2Mg+CO2![]() 2MgO+C(2分)
2MgO+C(2分)
五、(本题包括2小题,共18分。)
23、⑴28,(2)3(1分),A中至少有一个-OH和一个-COOH;但若氧原子数大于等于4,则M(A)>200(2分),C8H8O3,⑶![]() (2分)(合理答案即给分)
(2分)(合理答案即给分)
24.(9分)(1)![]() —CH3(1分),NH(C2H5)2(1分),(2)①④(2分),还原(1分), (3)不可,将导致苯环上-NO2引入至-COOH间位(2分),
—CH3(1分),NH(C2H5)2(1分),(2)①④(2分),还原(1分), (3)不可,将导致苯环上-NO2引入至-COOH间位(2分),
(4)O2N-![]() -COOH+HOCH2CH2N(C2H5)2
-COOH+HOCH2CH2N(C2H5)2![]() H2O+O2N—
H2O+O2N—![]() —COOCH2CH2N(C2H5)2
(2分)
—COOCH2CH2N(C2H5)2
(2分)
六、(本题包括2小题,共20分) ⑴⑵⑶⑷⑸⑹⑺⑻①②③④⑤⑥⑦⑧
25.(8分)(1)①6(2分),②NaHCO3、MgCO3(2分),KHCO3、CaCO3(2分),(2)0.200 mol(2分)
26.(12分)(1)设稀释后溶液的H+物质的量浓度为c(H+),依溶液电中性,有:(3.20g÷64g/mol)×2+c(H+)×1.00 L=0.200 mol/L×1.00L,解得c(H+)=0.100 mol/L,pH=-lgc(H+)=1 (3分)
(2)设n(NO2)=a mol,n(NO)=b mol,依电子得失守恒,有:a+3b=0.100 ①,依N元素守恒,有:a+b=0.030B-0.200 ②,解①②联立得:a=(0.045B-0.350)mol,b=(0.150-0.015B)mol
(3)依题意有不等式:n(NO2)>0,n(NO)>0,n(NO2)≥n(NO),即:0.045B-0.350>0,解得B>7.80;
0.150-0.015B>0,解得 B<10.0;0.045B-0.350≥0.150-0.015B,解得 B≥8.30;综合上述结果得:8.3≤B<10。(上、下限只算出一个且正确给1分)。