高三化学选择题专题训练(一)
满分67分
可能用到的相对原子质量:H 1 O 16 Na 23 Mg 24 Al 27 C1 35.5 K 39
Ca 40 Fe 56 Cu 64
一、选择题(每小题只有一个选项符合题意。每小题3分,共27分)
1.下列说法中,正确的是
A.由同种元素组成的物质一定是纯净物
B.由两种元素组成的分子中一定不存在非极性共价键
C.含有离子键的化合物一定是离子化合物
D.含有极性共价键的分子一定是极性分子
2.进行下列实验操作时,一般情况下不得相互接触的是
A. 配制溶液时,用以引流的玻璃棒与容量瓶内壁
B.过滤时,漏斗的下端与盛接滤液的烧杯内壁
C.实验室将HCl气体溶于水时,采用的倒置漏斗口与烧杯内的水面。
D.用以检验氨气的湿润红色石蕊试纸与产生氨气的试管口
3.下列叙述或表示方法中,正确的是
A.等质量的硫蒸汽和硫固体完全燃烧,后者放出的热量多
B.由C(石墨)→ C(金刚石);△H=+119kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H++OH-==H2O;△H=-57.3kJ/mol。若将含1molCH3COOH与含1molNaOH的稀溶液混合,放出热量小于57.3kJ
D.1L 0.5mol/L稀硫酸与1L1mol/L的NaOH溶液反应,放出57.3kJ的热,于是有:
H2SO4(aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(aq);△H=-57.3kJ/mol
4.在元素周期表中的短周期元素中,原子最外层电子数与其电子层数之比为1:1,2:1,3:1的元素共有
A.4种 B.5种 C.6种 D.7种
5.T℃时,bg固体A能完全溶解于水形成(a+b)g溶液。若固体A不含结晶水,也不与水反应;则T℃时,A的溶解度肯定不可能是
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
![]()
![]()
|
A.电池放电时,电池负极周围溶液的OH-浓度不断增大
B. 电池放电时,镍元素被氧化
C.电池充电时,氢元素被氧化
D.电池放电时,H2是负极
7.我国的科学家成功地研制出一种长期依赖进口、价格昂贵的物质![]() 。下列有关说法正确的是
。下列有关说法正确的是
A.它是O3的一种同素异形体
B.它是![]() 的同分异构体
的同分异构体
C.![]() 与
与![]() 互为同位素
互为同位素
D.1mol![]() 分子中含有20mol电子
分子中含有20mol电子
8.c(NH4+)相同的下列溶液:①氯化铵②硫酸铵③硫酸氢铵④碳酸氢铵,其物质的量浓度由大到小的顺序是
A.②③①④ B.②④①③ C. ①④③② D.④①③②
9.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.在25℃,压强为1.01×103Pa时,11.2L氮气所含的原子数目为NA
B.48g O3所含的原子数目为3NA
C.1mol氦气所含的电子数目为4NA
D.2.7g金属铝变为铝离子时失去的电子数目为0.1NA
二、选择题(每小题有一个或两个选项符合题意。每小题4分,共40分)
10.某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl):n(H2SO4)=3:2。若以石墨电极电解该溶液,下列推断中不正确的是
A、阴极产物为H2
B、阳极先析出Cl2,后析出O2
C、电解液的pH不断增大,最终大于7
D、整个电解的过程实质是电解水
11.氯酸钾和亚硫酸氢钾能发生氧化还原反应:
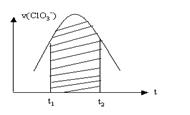
ClO3-+HSO3-→SO42-+Cl-+H+(未配平)
已知该反应的反应速率随c(H+)的增大而加快,上图为用ClO3-在单位时间内物质的量浓度变化表示的该反应的v-t图。下列说法中不正确的是
A、反应开始时速率增大可能是c(H+)增大所致
B、纵坐标为v(H+)的v-t曲线与图中曲线完全重合
C、后期反应速率下降的主要原因是反应物浓度减小
D、图中阴影部分“面积”可以表示为t1-t2时间内c(Cl-)的增加
12.下列各组离子能大量共存于同一溶液中,且加入适量NaOH溶液或少量稀H2SO4时,都能产生沉淀的是
A. Ba2+、Mg2+、NO3-、CO32-
B. Na+、Al3+、Cl-、AlO2-
C. Ba2+、K+、Cl-、HCO32-
D. NH4+、Fe3+、Ba2+、Cl-
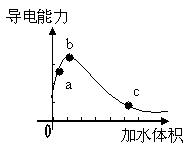 13.一定温度下,将一定质量的冰醋酸加水稀释过程中,
13.一定温度下,将一定质量的冰醋酸加水稀释过程中,
溶液的导电能力变化如右图所示,下列说法正确的是
A. a、b、c三点溶液的pH:c<a<b
B. a、b、c三点醋酸的电离程度a<b<c
C. 用湿润的pH试纸测a处溶液的pH,测定结果偏小
D. a、b、c三点的溶液用1mol/L氢氧化钠溶液中和,
消耗氢氧化钠溶液的体积:c<a<b
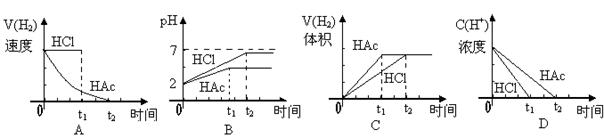
14.向体积均为1L,pH均等于2的盐酸和醋酸中,分别投入0.28gFe,则下图中的曲线符合事实的是
15.在某温度下,将2molA和3molB充入一密闭容器中,发生反应:
aA(g)+B(g) ![]() C(g)+D(g),5min后达到平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)=c(C)·c(D)。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达到平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)=c(C)·c(D)。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A.60% B.40% C.24% D.4%
16.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.Na2SO3溶液和过量氧气
B.FeSO4溶液和过量溴水
C.等物质的量的NaHCO3和Na2O2固体
D.溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液
17.下列离子方程式正确的是
A.把Fe(OH)3放入氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
B.Mg(HCO3)2溶液和足量澄清石灰水反应:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
C.Ca(HCO3)2溶液与过量NaOH溶液反应: Ca2++HCO3-+OH-=CaCO3↓+H2O
D.把Mg粉放入FeCl3溶液中:2Fe3++3Mg+6H2O=2Fe(OH)3↓+3Mg2++3H2↑
18.有一种混合气体,它可能由CO、CO2、SO2、HCl中的一种或多种气体组成。该气体依次通过下列物质的现象如下:通过澄清石灰水无白色沉淀析出;通过品红溶液溶液红色褪去;通过炽热的CuO固体变成红色,通过澄清石灰水出现白色沉淀。该混合气体组成的说法中正确的是
A.肯定不含有CO2
B. 只含有CO和SO2
C.含有SO2、CO和CO2,可能含有HCl
D.含有HCl、SO2和CO,可能含有CO2
19.下列各组溶液混合后,溶液的pH一定大于7的是
A.将等物质的量的HNO3、Na2CO3、CH3COOH溶液混合
B.pH=2的盐酸和pH=12的氨水等体积混合
C.pH=3的某酸和pH=11的某碱等体积混合
D.pH=2的醋酸和pH=12的NaOH溶液等体积混合
答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | C | D | C | D | A | D | B | CD |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| 答案 | B | CD | BC | BC | B | AD | D | D | AB |