高三化学学科综合模拟试题
化学备课组
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.回答I卷前,考生务必在答题卡姓名栏内写上自己的姓名、考试科目、准考证号,并用2B铅笔涂写在答题卡上。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题卡和第II卷一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Fe-56
Cl-35.5 Br-80 Ba-137 Cu-64 I-127
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、唐代医书《外台秘要》一书中记载了水银霜的制法:将水银(即汞)和硫磺共炒后再加入NaCl灼炒之,倒扣一铜盆,片刻后,铜盆内壁便附着一层白色的水银霜。据此可知水银霜的化学成分为
A.HgS B.Na2S C.HgCl2 D.Hg2Cl2
2、2005年2月18日英国食品标准署就食用含有添加苏丹红色素的食品可能诱发癌症向消费者发出警告。我国也已开始追查含苏丹红色素的食品。所谓“苏丹红一号”实际上一般称为“苏丹一号”,是一种黄溶剂染料,按化学染料分类称为溶剂黄14(C.L.Solvent,Yellow14),分子式为C16H12N2O,其化学结构属偶氮类染料,是由苯胺重氮化后与2-萘酚偶合制得。有关苏丹红一号下列说法正确的是
A.苏丹红一号在食品中能起到增色的作用,可在辣椒酱中用作添加剂
B.从苏丹红一号分子中碳氢原子个数比例分析,其为不饱和烃
C.苏丹红一号可用于溶解剂、机油、蜡和鞋油等产品的染色
D.食品添加剂对人体危害较大,因此应全面禁止使用
3、下列物质按不同类别分组,所得组合最不合理的是
(1)糖类(2)塑料(3)石油(4)蛋白质(5)合成纤维(6)棉花(7)陶瓷(8)玻璃(9)天然气(10)水泥(11)合成橡胶(12)煤(13)油脂(14)羊毛
A、(1)(4)(13) B、(2)(5)(11)
C、(7)(8)(11)(14) D、(3)(9)(12)
4、法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称为“零号元素”。下列有关“四中子”粒子的说法错误的是
A、该粒子不显电性 B、该粒子质量数为4
C、该粒子质量比已发现的氢原子大 D、在周期表中与氢元素占同一位置
5、最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A、Mg +2HCl = MgCl2 + H2↑ B、NaOH + HCl = NaCl + H2O
C、NH3 +
HCl = NH4Cl D、H2O +CH3COOH ![]() H3O+ +CH3COO
-
H3O+ +CH3COO
-
6、下列除去杂质的方法正确的是
A、除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
B、除去N2中的少量的CO:通过足量的灼热的CuO粉末
C、除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
D、除去铜粉中混有的铁:加足量稀硝酸,过滤
7、实验室利用反应:Na2S2O3+H2SO4====Na2SO4+S↓+SO2↑+H2O,以溶液变浑浊时间的长短来研究影响化学反应速率的因素,下列各组实验中化学反应速率最大的是
组号反应
| 组号 | 反应 温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O的 体积(mL) | ||||
| 体积(mL) | 浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
8、醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程
中,溶液的导电能力变化如右下图所示,有关说法正确的是
A、a、b、c三点溶液的pH:a>b>c
B、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
C、a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D、若在“O”点醋酸双聚成八元环分子,则其结构为:
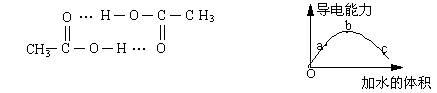
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9、以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A、1L0.1mol·L-1的醋酸溶液中含离子和分子总数是0.1NA
B、22.4L氖气中所含原子数为NA
C、1.6gNH2-离子中所含电子数为NA
D、2gD2O所含中子数为NA
10、美国美国梅奥诊所的研究人员最近发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为: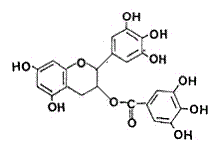
有关EGCG的说法正确的是
A、EGCG能与碳酸钠溶液反应放出二氧化碳
B、EGCG遇FeCl3溶液能发生显色反应
C、1molEGCG最多可与含10mol氢氧化钠的溶液完全作用
D、EGCG在空气中易氧化
![]() 11、在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)
xC(g),达到平衡后,
11、在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)
xC(g),达到平衡后,
C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、
C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
A、平衡时A 、B的物质的量之比一定为2:1
B、x的值可能是2,也可能是3
C、平衡时A 的物质的量与原平衡一定相等
D、C的体积分数不可能为W%
12、在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A、滴加石蕊试液显红色的溶液 :
Fe3+、NH4+、Cl―、I―
B、pH值为1的溶液 :
Cu2+、Na+、Mg2+、NO3―
C、水电离出来的c(H+)=10-13 mol/L的溶液:
K+、HCO3―、Br―、Ba2+
D、所含溶质为Na2SO4
的溶液:
K+、CO32―、NO3―、Al3+
13、下列反应的离子方程式错误的是
A、足量的CO2通入饱和碳酸钠溶液中
CO2+CO32—+H2O=2HCO3—
B、氢氧化铁与足量的氢溴酸溶液反应
Fe(OH)3+3H+=Fe3++3H2O
C、等物质的量的Ba(OH)2与NH4HSO4在溶液中反应
Ba2++2OH—+NH4++H++SO42—=BaSO4↓+NH3·H2O+H2O
D、向碳酸氢钠溶液中滴入过量澄清石灰水
Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O
14、溶质为11.2g的KOH稀溶液与0.1L 1.0mol•L-1的H2SO4溶液反应可放出11.46kJ的热量。下列能表示中和热的热化学方程式为( )
A.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-11.46 kJ•mol-1
B.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH=-114.6 kJ•mol-1
C.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH= +114.6 kJ•mol-1
D.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-57.3 kJ•mol-1
15、几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A、L、M的单质与稀盐酸反应速率L>M
B、M与T形成的化合物有两性
C、Q、T两元素的氢化物分子间存在氢键
D、L、Q形成的简单离子核外电子数相等
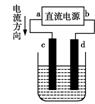 16、右图是电解CuSO4溶液的装置,其中c、d为石墨电极。则下列有
16、右图是电解CuSO4溶液的装置,其中c、d为石墨电极。则下列有
关的判断正确的是
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量不变
D.电解过程中,溶液pH变小
17、NH3和O2混合气100mL通过红热的铂网,充分反应后的混合气再通过足量水最终收集
到10mL残留气体,则原混合气中O2体积不可能是(气体体积在相同条件下测定)
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
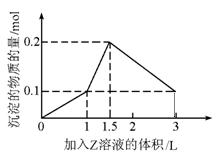 18、1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液
18、1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液
Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、
Z分别是
A、氯化铝、氯化铁、氢氧化钠
B、氯化铝、氯化镁、氢氧化钠
C、偏铝酸钠、氢氧化钡、硫酸
D、偏铝酸钠、氯化钡、硫酸
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
![]() 19、(10分)⑴下列仪器中,根据物质的沸点不同分离物质时需要的是
(填编号)。
19、(10分)⑴下列仪器中,根据物质的沸点不同分离物质时需要的是
(填编号)。
 ①容量瓶 ②普通漏斗 ③蒸馏烧瓶
①容量瓶 ②普通漏斗 ③蒸馏烧瓶
④天平 ⑤分液漏斗 ⑥滴定管
⑦燃烧匙 ⑧温度计 ⑨干燥管
⑵ 右图分别是温度计、量筒、滴定管的一
部分,下述读数(虚线刻度)及说法正确
的是 。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
![]()
![]()
![]()
![]()
![]() C.③是滴定管,读数为3.5mL
C.③是滴定管,读数为3.5mL
D.①是温度计,读数为2.5℃
⑶ 实验室里不同化学试剂的保存方法不尽相同。下图中A、B、C、D、E是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内(多选倒扣分):
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦氯水 ⑧浓硝酸
| A | B | C | D | E |
|
| |
|
|
|
| ( ) | ( ) | ( ) | ( ) | ( ) |
20、(12分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为: 4MnO4—+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4—+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
⑵ 测定装置:部分装置如下图所示(a、b为止水夹)
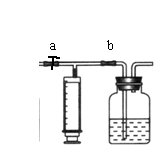
|
|

⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L—1H2SO4溶液备用。
③ 将2.00×10—3mol·L—1的草酸标准溶液置于 (填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
| 装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.27 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);
草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)
则:计算室内空气中甲醛浓度(mg/m3)的代数式为 ,计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
四、(本题包括2小题,共18分)
21、(8分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式)
_____________ > ______________ 。
(2)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式:_____________________________________________________________ 。
(3)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应、且生成气体的离子方程式:_______________________________________________________________。
(4)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池的电极反应方程式:
负极 :____________________________________;
正极 :_______________________________________。
22、(10分)已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
试回答下列:
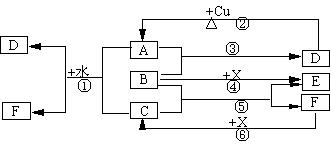
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 。
(2)B的电子式为: 。
(3)写出反应②的化学方程式: 。
(4)写出反应①、⑥的离子方程式
①__________________________________________________;
⑥__________________________________________________。
五、(本题包括2小题,共18分)
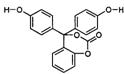
![]()
|
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
(1)该有机物分子中的三个苯环_________ 共平面
(选填“能”或“不能”)。
(2)该有机物的的化学式为 ________________。
(3)该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量较小钠盐的化学式为 ____________________________________________________________________。
(4)1mol该有机物在铜铬氧化物催化下能与 ______________mol氢气充分反应。
24、(10分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为: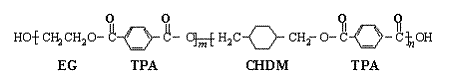
已知:
(1)![]()
(2)RCOOR1 +R2OH ![]() RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
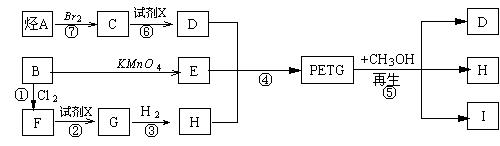
试回答下列:
(1)反应②⑥加入的试剂X是 ; (2)⑤的反应类型是 ;
(3)写出结构简式:B I ;(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= ∶ ∶ (用m、n表示)
(5)写出化学方程式:
反应③ _;反应⑥ _____。
六、(本题包括2小题,共18分)
25、(6分)有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液跟2.00mol/LNaOH溶液反应,共用去35.00mL碱液时恰好中和。试完成下列
(1)则混合溶液中硝酸的物质的量浓度 c (HNO3) = mol/L
(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,反应的离子方程式为:
在标准状况产生的气体体积为 mL。
26、(12分)在标准状况下将cmolCl2通入含amolFeBr2、bmolFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1) 将下表中空格填满:
| c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式 (只要求写盐类化合物) |
| FeBr2、FeI2、FeCl2 | |
| b≤c<1/2(a+3b) | |
| FeBr3、FeCl3 | |
| FeCl3 |
(2)若a=b=1 、c=2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a=b=1 、c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应):_________________________________________________________.
化学参考答案及评分标准
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.C 2.D 3.D 4.B 5.C 6.B 7.D 8.D
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.CD 10.BD 11.AB 12. B 13.AD 14.C 15.AB 16.C 17.B 18.C
三、(本题包括2小题,共22分)
19.(9分)⑴ ③⑧ (2分) ⑵ BD(2分) ⑶ ⑤、④、①③、②⑥、⑦⑧(6分)
20.(12分)
⑶ ②酸式滴定管或移液管,(1分) ③酸式滴定管;(1分)
④甲醛吸收不充分,影响测定结果;(1分)
⑤偏高;(2分)
⑥不需要,加入最后一滴草酸溶液时溶液褪色且半分钟内不重新变红(2分)
⑷ (75clVl—30c2V2) ×103;(2分) 27.60 (2分) 不能 (1分)
四、(本题包括2小题,共18分)
21、(10分)(1)HClO4>H2SO4(2分) (2)Cl2 + 2NaOH = NaCl + NaClO + H2O(2分)
(3)H+ + HSO3— = SO2↑+H2O (2分)
(4)2H2 + 4OH— -4e = 4H2O O2 + 2H2O + 4e = 4OH—(各2分)
22、每空均2分
(1)X>C>B>D(或写作MnO2 >Cl2> H2O2 >H2SO4)
(2)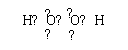
(3)Cu +2H2SO4(浓)![]() CuSO4 +SO2 ↑+2H2O
CuSO4 +SO2 ↑+2H2O
(4)Cl2 +SO2 +2H2O = 4H+ +SO42-+2Cl-
MnO2
+4H+ + 2Cl-![]() Mn2+ +Cl2 ↑+2H2O
Mn2+ +Cl2 ↑+2H2O
五、(本题包括2小题,共18分)
23.(10分)(1)不能 (2分) (2)C20H14O5(2分) (3)Na2CO3 (3分) (4)3 (3分)
24、每空均2分,共14分
(1)NaOH溶液(2)取代(或醇解);
(3)![]()
(4)m∶(m+n)∶n
(5)③ ![]() +5H2
+5H2 ![]()
![]()
⑥CH2Br-CH2Br +2H2O ![]() CH2OH -CH 2OH +2HBr
CH2OH -CH 2OH +2HBr
六、(本题包括2小题,共18分)
25、(每空均2分,共6分)
(1)3.00mol/L
(2) 3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑ +4H2O ;373.1mL
26.(10分)
(1)(每空1分),
| 0<c<b | |
| FeBr2 FeBr3 FeCl2 FeCl3 | |
| 1/2(a+3b) ≤c<3/2(a+b) | |
| c ≥ 3/2(a+b) |
(2)FeBr3、FeCl3 1:2 (每空2分)
(3)4Fe2+ + 4I- + 2Br- +5Cl2 ===4Fe3+ + 2I2 +Br2 + 10Cl-(2分)