高三化学氧化还原反应
1、氧化还原反应
(1)定义:凡有电子转移(电子得失或共用电子对偏移)的反应叫氧化还原反应。
(2)特征:反应前后元素的化合价发生改变。
(3)实质:有电子转移。
判断一个反应是否是氧化还原反应,关键要看反应前后元素的化合价是否发生改变。
思考:有单质生成的反应一定是氧化还原反应吗?
2、基本概念及其之间的关系
氧化剂:得到电子(或元素化合价降低)的物质
还原剂:失去电子(或元素化合价升高)的物质
氧化反应:失去电子(或元素化合价升高)的反应
还原反应:得到电子(或元素化合价降低)的反应
氧化性:物质得到电子的能力或性质
还原性:物质失去电子的能力或性质
氧化产物:还原剂被氧化后所对应的产物
还原产物:氧化剂被还原后所对应的产物
基本概念之间的关系:
氧化剂![]() 有氧化性
有氧化性![]() 化合价降低
化合价降低![]() 得电子
得电子![]() 被还原
被还原![]() 发生还原反应
发生还原反应![]() 生成还原产物
生成还原产物
还原剂![]() 有还原性
有还原性![]() 化合价升高
化合价升高![]() 失电子
失电子![]() 被氧化
被氧化![]() 发生氧化反应
发生氧化反应![]() 生成氧化产物
生成氧化产物
3、电子转移的表示方法
![]() (1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
(1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
|
 |
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
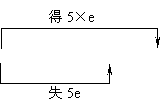 3Cl2+6KOH
3Cl2+6KOH![]() KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
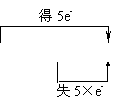 ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
|
|
|
![]()
![]() KClO3+6HCl
KClO3+6HCl![]() 3Cl2+ 6KCl↑ +3H2O Cl
Cl
Cl
3Cl2+ 6KCl↑ +3H2O Cl
Cl
Cl
|
|
|
![]()
![]() 若理解为右图则错了。
Cl
Cl
Cl
若理解为右图则错了。
Cl
Cl
Cl
![]()
4、氧化还原反应方程式的配平
(1)配平依据:化合价升降总数相等或电子转移总数相等。
(2)配平方法:化合价升降法或电子转移法。
(3)配平步骤:
①标价态:标出反应前后化合价有变化的元素的化合价。②列变化:列出反应前后化合价的改变情况。③求总数:根据化合价升降总数相等求最小公倍数。④配关键化学计量数。⑤用观察法配平其他物质的化学计量数。⑥检查两边原子个数和电荷是否守恒。
(4)氧化还原反应离子方程式的配平
首先利用化合价升降法配平参加氧化还原反应的离子或分子的化学计量数;然后利用电荷守恒和质量守恒配平未参加氧化还原反应的离子或分子的化学计量数。如:
MnO4―+ H2S+ H+ —— Mn2+ + S↓ + H2O
(5)缺项氧化还原方程式的配平
先配平含变价元素物质的化学计量数,再通过比较反应物与生成物,观察增减的原子或离子数确定未知项及其化学计量数,缺项一般是水、酸、碱等。如:
Cu2S + NO3― —— Cu2++ S↓+ NO↑ + H2O
巧思巧解
1、氧化性、还原性强弱的判断
(1)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e_-------Na+, Al-3e――――Al3+,但根据金属活动表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
从元素的价态考虑:最高价态___只有氧化性,如Fe3+、H2SO4、KMnO4等;
最低价态___只有还原性,如金属单质、Cl-、S2_等;
中间价态___既有氧化性又有还原性,如Fe2+、S、Cl2等
(2)常用判断方法
①根据金属活泼性判断:
金属性越强,单质的还原性越强,其对应离子的氧化性越弱。
单质还原性:按金属活动性顺序表的顺序依次减弱。
离子氧化性:按金属活动性顺序表的顺序依次增强(铁指Fe2+)。
如氧化性:Ag+>Hg2+>Fe3+>Cu2+>H+>Fe2+
②根据非金属的活泼性判断:
非金属性越强,单质的氧化性越强,其对应离子的还原性越弱。
单质氧化性:F2>Cl2>Br2>I2>S
离子还原性:S2_>I->Br->Cl->F-
③通过化学反应比较:氧化剂+还原剂![]() 氧化产物+还原产物
氧化产物+还原产物
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
④通过与同一物质反应的产物比较:如:2Fe+3Cl2 ======2FeCl3 ,Fe+S======FeS ,可得出氧化性Cl2 >S。
⑤由反应条件的难易比较:
不同氧化剂与同一还原剂反应,反应条件越易,氧化性越强;不同还原剂与同一氧化剂反应,条件越易,还原性越强。如卤素单质与H2的反应,按F2、Cl2、Br2、I2的顺序反应越来越难,反应条件要求越来越高,则可得出氧化性F2>Cl2 >Br2 >I2 。
⑥对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe;价态越低,氧化性越弱,如S2―<S<SO2。(特例:氧化性HClO>HClO2>HClO3>HClO4 )
⑦某些氧化剂的氧化性和还原剂的还原性与下列因素有关:
温度:如浓H2SO4具有强氧化性,热的浓H2SO4比冷的浓H2SO4氧化性要强。
浓度:如硝酸具有强氧化性,硝酸越浓其氧化性越强。
酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。(一般地,在酸性环境中,KMnO4的还原产物为Mn2+;在中性环境中,KMnO4的还原产物为MnO2;在碱性环境中,KMnO4的还原产物为K2MnO4 。)
2、重要的氧化剂和还原剂
重要的氧化剂:
(1)活泼非金属单质,如F2、Cl2、Br2、O2 、I2、O3 等。
(2)高价含氧化合物,如浓H2SO4、HNO3、KMnO4、HClO、KClO3、MnO2、Na2O2、
H2O2、K2Cr2O7等。
(3)高价金属阳离子,如Ag+、Hg2+、Fe3+、Cu2+等。
重要还原剂:
(1)活泼金属及某些非金属单质,如Na、Mg、Al、H2、C、Si等;
(2)低价态化合物,如CO、H2S、HCl、SO2、NH3等;
(3)低价态的某些离子,如S2―、SO32―、Fe2+、I―等。
3、电子得失守恒法
守恒法是化学计算的基本方法,电子得失守恒是其中的一种,但凡氧化还原反应别忘了电子得失守恒法的应用。
例:为了测定Cu、Ag合金的成分,将30.0g合金溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到标准状况下6.72L气体,并测得溶液中c(H+)=1mol/L。若反应后溶液体积仍为80mL,试填写:
(1)产物中气体的成分(填化学式)及体积是 ;
(2)被还原的HNO3的物质的量为 ;
(3)合金中Ag的质量为 。
例题精析:
例1 在3BrF3+5H2O=HBrO3+Br2+O2↑+9HF反应中,若有2mol H2O被氧化,则被水还原的BrF3有几摩尔? (4/3 mol)
思考:P+CuSO4+H2O ——H3PO4+Cu3P+H2SO4(未配平),问1mol CuSO4能氧化几摩尔P?
例2 配平下列化学方程式:
(1)CH4+O2+Na2O2——Na2CO3+NaOH
例3 将一定量的KClO3加热发生部分分解,然后向反应物中加足量的浓H2SO4并加热,发生如下反应:KClO3+5KCl+3H2SO4 ![]() 3Cl2↑+3K2SO4+3H2O,如果原KClO3为A mol,
3Cl2↑+3K2SO4+3H2O,如果原KClO3为A mol,
第一步反应KClO3的分解率为a,两步反应产生的O2和Cl2共n mol。
(1)计算当氯元素全部转化为Cl2时a、n的值。(a=5/6,n=1.75A)
(2)讨论a在不同取值范围内的n值,并与(1)中所得n值比较,确定n的最大值。(1.75A)
MnO4― +H2S +H+ = 2Mn2+ +5S↓+8H2O
3Cu2S + 4NO3― +16H+ = 6Cu2+ +3S↓+4NO↑+8H2O
例(1)NO2:2.24L;NO:4.48L (2)0.3mol (3)10.8g
例1. 4/3
例2. 2CH4 +O2 +6Na2O2 =2Na2CO3 +8NaOH