高三化学易错题集(二)
1. 下列选项中所涉及到的两个量一定相等的是
A.等物质的量的Al分别与足量的盐酸、烧碱反应转移的电子数
B.36gH2O和1.204×1024个O2在标准状况下的所占体积
C.pH相等的氨水与醋酸钠溶液中由水所电离出的OH—浓度
D.pH相等的H2SO4和CH3COOH稀释相同倍数之后溶液的pH
2.某溶液中含有HCO3- 、SO32- 、CO32- 、NO3- 四种阴离子,向其中加入Na 2 O 2 固体,溶液中离子浓度基本不变的是 ( )
A.HCO3- B.NO3- C.CO32- D.SO32-
3.在一个固定容积的密闭容器中进行反应: ![]() ,一定条件下达到平衡后,再向容器中通入少量HCl气体,产生的结果是 ( )
,一定条件下达到平衡后,再向容器中通入少量HCl气体,产生的结果是 ( )
A.容器内压强增大 B.原平衡不受影响
C.正反应速率增大 D.NO浓度降低
4.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2中不同价态的氯在酸性条件下可以生成C12。下列关于混盐CaOCl 2 的说法不正确的是 ( )
A.CaOCl 2 与稀硫酸反应产生1mol Cl 2 时转移2mol电子
B.CaOCl 2 的水溶液呈碱性 C.CaOCl 2 具有较强的氧化性
D.CaOCl 2 中氯元素的化合价为+1、-1
5.强碱与强酸在稀溶液中发生中和反应的热效应:
H + (aq)+OH - (aq)=H 2 O(l);ΔH=-57.3kJ/mol
取三份100mL0.5mol·L -1
的NaOH溶液,分别用0.5mol·L-1
醋酸溶液、18mol·L-1 硫酸溶液、1mol·L-1 硝酸溶液进行中和。若反应恰好完全时的热效应分别为ΔH 1 、ΔH 2 、ΔH 3 ,它们的正确关系是 ( )
A.ΔH 1 >ΔH 2 >ΔH 3 B.ΔH 2 >ΔH 1 >ΔH 3
C.ΔH 1 >ΔH 3 >ΔH 2 D.ΔH 2 >ΔH 3 >ΔH 1
6、下列关于铜电极的叙述不正确的是
A、铜锌原电池中铜是正极 B、用电解法精炼粗铜时粗铜作
阴极C、在镀件上电镀铜时可用金属铜作阳极 D、电解稀硫酸制H2、O2时铜作阳极
11、恒温恒压下,在容积可变的器皿中,反应2NO2(气)![]() N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
A 不变 B 增大 C 减小 D 无法判断
7、用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是( )
A.4 B.7.2 C.10 D.11.3
8、室温下,在PH=12的某溶液中,由水电离的c(OH-)为( )
A.1.0×10-7 mol·L-1 B.1.0×106 mol·L-1 C.1.0×10-2 mol·L-1 D.1.0×10-12 mol·L-1
9.已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
10.据CCTV《科技博览》报道,2004年3月中科院首创用CO 2 合成可降解塑料聚二氧化碳。下列相关说法中,合理的是 ( )
A.聚二氧化碳塑料是通过加聚反应制得的 B.聚二氧化碳塑料与干冰互为同素异形体 C.聚二氧化碳塑料的使用会产生白色污染 D.聚二氧化碳塑料与干冰相似,都易气化
11、含ng H NO3的稀溶液与含mg铁粉充分反应,铁全部溶解,生成NO气体,已知有n/4gH NO3被还原,则n :m可能是( )
A、1 :1 B、 2 :1 C 、5 :1 D、18 :5
12、向密度为d g/cm3的盐酸中逐滴加入AgNO3溶液至过量,生成沉淀的质量与原盐酸的质量相等。则原盐酸的物质的量浓度为()
A、25.4 dg/cm3 B、12.7dg/cm3 C、6.97dg/cm3 D、6.35 dg/cm3
13、0.1 mol/LH2S溶液中加水稀释为0.01 mol/L时,下列微粒浓度减小量最多的是() A、H2S B、HS— C、H+ D、S2—
14、随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
A 无水硫酸铜、蔗糖 B 硅胶、硫酸亚铁
C 食盐、硫酸亚铁 D 生石灰、食盐
15.有物质的量浓度、体积都相同的NaF溶液和NaCN溶液。已知HF比HCN较易电离。以下说法中正确的是
A. 两溶液相比较,NaCN溶液中的离子总数较多B.两溶液中的c(Na+) 、c(H+)分别相等
C.NaCN溶液中c (OH-) = c (H+) + c(HCN) D.NaF溶液中c(Na+) > c (F-) > c(OH-) >c(H+)
16.下列离子方程式中正确的是( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl-=2Fe3++Br2+4Cl-
17.在铜的催化作用下氨气和氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法不正确的是( )
A.该反应的化学方程式为4NH3 + 3F2 = NF3 + 3NH4F
B.M是极性分子,其还原性比NH3强C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
18.下列有关溶液的叙述中,正确的是( )
A.强电解质在水中溶解度一定大于弱电解质在水中的溶解度
B.将20℃时KCl溶液降低温度,所得溶液的质量分数一定会减小
C.某物质饱和溶液的质量分数为a%,该温度下该物质的溶解度一定大于ag。
D.将标准状况下的饱和CO2水溶液置于常温下,一定会放出CO2气体
19.利用下图装置做下面的实验:在烧杯中盛有半杯乙溶液,然后用滴定管向容器中滴入甲溶液。随着甲的滴入,灯泡逐渐变暗;滴到一定量时,灯泡熄灭,继续滴入甲溶液,灯泡又逐渐变亮。下列各组溶液中,能够产生上述现象的是
| 选项 | 甲 |
|
| A | NH3·H2O | AgNO3 |
| B | CH3COOH | NH3·H2O |
| C | NaOH | AlCl3 |
| D | H2SO4 | Ba(OH)2 |
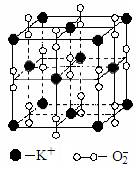 20.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
20.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
21.在硫酸铁溶液中,加入ag铜,完全溶解后,又加入bg铁,
充分反应后得到cg残余固体,且b<c,则下列判断正确的是
A. 最后得到的溶液中不含有Fe3+
B.残余固体可能为铁、铜混合物
C、最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
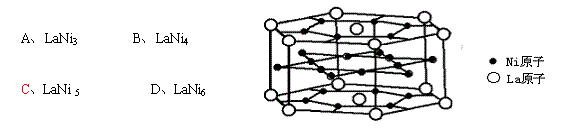
22、氢是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式:
23.(8分)⑴现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 ,你认为该溶液pH的范围一定介于 之间。
⑵为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
24.(10分)燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
⑴固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:
电池正极 ;
电池负极 。
⑵某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为 ,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是 g(结果精确至0.01g)。
25.(10分)将3.20g Cu溶于amol·L-1过量的硝酸溶液30.0mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩余溶液加水稀释至1000mL,测得c(NO3-)为0.200mol·L-1。求:
⑴稀释后溶液的pH。
⑵生成的气体中NO2和NO的物质的量(用含“a”的关系式表示)。
⑶用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
24.(1)负 13O2+52e- 26O2- 2C4H10+26O2--52e- 8CO2+10H2O
(2)+3 1.34(每空2分,共10分)
25.⑴n(Cu)=![]() =0.05mol
=0.05mol
c(Cu2+)=0.05mol·L-1
根据电荷守恒:c(NO3―)=2c(Cu2+)+c(H+)
c(H+)=c(NO3―)-2c(Cu2+)=0.200mol·L-1-2×0.05mol·L-1=0.1mol·L-1
pH=-lg0.1=1(2分)
⑵根据物料守恒:n(NO2)+n(NO)+n(NO3―)=0.03a
根据电子守恒:n(NO2)+3n(NO)=0.05mol×2
n(NO2)=(0.045a-0.350)mol (2分)
n(NO)=(0.150-0.015a)mol (2分)
⑶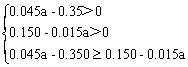
8.3≤a<10 (2分)
 乙
乙