高三化学模拟测试
可能用到的相对原子质量:
C-12,Si-28,
第I卷 (选择题,共60分)
一、选择题
(本题包括5小题,每小题只有一个正确答案,5×4=20分)
1.下列物质中,化学式能准确表示该物质分子组成的是( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2)
C.白磷(P4) D.硫酸钠(Na2SO4)
2.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO3和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
3.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是( )
A.NCl3晶体为原子晶体 B.分子中N—Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子 D.N—Cl键能大,故NCl3沸点高
4.下列晶体中,其中任何一个原子都被相邻四个原子包围,以共价键形成正四面体,并向空间伸展成网状结构的是( )
A.四氯化碳 B.石墨 C.金刚石 D.水晶
5.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
二、选择题
(本题包括10小题,有1—2个正确答案,10×4=40分)
6.分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.溴化铝,无色晶体,熔点98℃,熔融态不导电
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
7.下列晶体熔化时,化学键没有被破坏的是( )
A.氯化铵 B.金刚石 C.冰醋酸 D.硫酸钠
8.石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合。下图是石墨的晶体结构俯视图,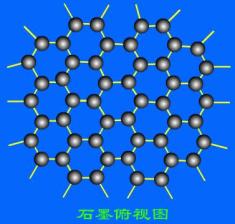 图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )
图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为( )
A.1:3 B.2:3 C.2:1 D.3:2
9.下列说法不正确的是( )
A.全部由非金属元素组成的化合物一定不是离子化合物
B.金属原子与非金属原子之间的化学键可能是离子键,也可能是共价键
C.晶体中有阳离子,则必定有阴离子
D.晶体中有阴离子,则必定有阳离子
10.下列各组物质的晶体中,化学键的类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
11.合金有许多特点,如NaK合金为液体,而Na、K的单质均为固体。据此推测生铁、纯铁、石墨三种物质中,熔点最低的是( )
A.纯铁 B.生铁 C.碳 D.无法确定
12.目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中不正确的是( )
A.是一种新型化合物 B.晶体属于分子晶体
C.是两种单质组成的混合物 D.相对分子质量为2400
13.碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素是+3和+5两种价态,这种化合物的化学式是( )
A.I2O3 B.I2O4 C.I4O7 D.I4O9
14.下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>GeH4>SnH4 B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.石墨>金刚石>SiO2>MgO
15.20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。90年代初,科学家又发现了管状碳分子和洋葱状碳分子。(如图1-5):下列说法错误的是( )
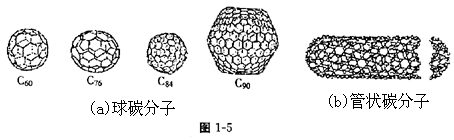
A.金刚石和石墨的熔点肯定要比C60高
B.据估计C60熔点比金刚石和石墨要高
C.无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体
D.球碳分子是碳的同素异形体,而管状碳分子、洋葱状碳分子则不一定
第Ⅱ卷 (非选择题,共90分)
三、填空题
(本题包括2小题,共28分)
16.氮化硅Si3N4是一种非氧化物高温陶瓷结构材料。粉末状的Si3N4可以由SiCl4的蒸气和NH3气的混合物反应制取。粉末状Si3N4对空气和水都不稳定。但是,将粉末状Si3N4和适量MgO在230×1.01×105Pa和185℃的密闭容器中热处理,可以得到结构十分紧密、对空气和水都相当稳定的固体材料。
(1)写出由SiCl4的蒸气和NH3气制备Si3N4的反应方程式;
(2)分别写出粉末状Si3N4和H2O及O2反应的方程式;
(3)为什么结构紧密的固体Si3N4不再受H2O和O2的侵蚀?
17.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态;②在BGO中,铋的价态与铋和氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构;③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是_______和______。
(2)BGO晶体的化学式是______。
(3)BGO晶体中所含铋氧化物的化学式是______。
四、填空题
(本题包括3小题,共27分)
18.Pt (NH3)2
Cl2成平面四边形结构,它可以形成两种固体,一种为淡黄色,在水中溶解度较小;另一种为黄绿色,在水中溶解度较大。
(1)画出这两种固体分子的几何构型图:_________。
(2)黄绿色固体溶解度大的原因是:_________。
19.二氧化硅晶体中,每个硅原子周围有_________个氧原子,每个氧原子周围有_________个硅原子,硅氧原子个数比为_________。若去掉二氧化硅晶体中的氧原子,且把硅原子看做碳原子,则所得空间网状结构与金刚石空间网状结构相同,试推测每个硅原子与它周围的4个氧原子所形成的空间结构为_________型;并推算二氧化硅晶体中最小的硅氧原子环上共有_________个原子。
20.
(1)BN是一种新型的无机材料,由于 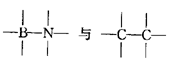 属等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料;另一种是类似于_________的层状结构的混合型晶体,可作用润滑材料,在其结构的每一层上最小的封闭环中有 _________个B原子,B—N键键角为_________。
属等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料;另一种是类似于_________的层状结构的混合型晶体,可作用润滑材料,在其结构的每一层上最小的封闭环中有 _________个B原子,B—N键键角为_________。
(2)单质硼有无定形体和晶体两种,参考下表数据。
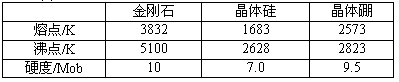
①晶体硼的晶体类型属于 晶体,理由是_________。
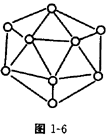
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图1—6所示),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成。其中B—B键的键角为_________。
五、实验题
(本题包括2小题,共16分)
21.根据实验测定硫酸铜晶体中结晶水含量的实验,填写以下空白。
(1)从以下仪器中选出所需仪器(用字母填写)。
(A)托盘天平;(B)研钵;(C)试管夹;(D)酒精灯;(E)蒸发皿;(F)玻璃棒;(G)坩埚;(H)干燥器;(I)泥三角;(J)石棉网;(K)三角架;(L)药匙;(M)坩埚钳。
(2)实验后得到以下数据:
①加热前质量:W1(容器)=5.4g;W2(容器十晶体)=7.9g;
②加热后质量:W3(容器十无水硫酸铜)=6.8g。
请写出结晶水含量——质量分数的计算式(用Wl、W2、W3表示):______这一结果是偏高还是偏低?_______。
从下列分析中选出造成实验误差的原因可能是(填写字母)________。
A.加热前称量时容器未完全干燥 B.最后两次加热后质量相差较大(>0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
22.现有八种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖,请用编号填写下列空白。
(1)通过非极性键形成原子晶体的是_______。
(2)固态时属于分子晶体的是_______。
(3)属于分子晶体,且分子为直线型的是_______。
(4)由单原子分子构成的分子晶体的是_______。
(5)含有非极性键的离子化合物的是_______。
六、填空题
(本题包括2小题,共19分)
23.有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出这五种元素的名称:A_______,B_______,C_______,D_______,E_______。
(2)画出E的原子结构示意图_______。写出电子式D2A2_______,EB4_______。
(3)比较EA2与EB4的熔点高低(填化学式)_______>_______。
(4)写出D单质与CuSO4溶液反应的离子方程式。
24.
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近的O2—核间距离为a×10—8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。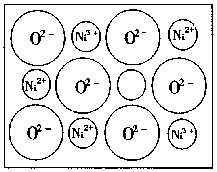
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算晶体中Ni3+与Ni2+的离子数之比。