高三化学期中测试人教版大开本、
【模拟试题】
一、选择题
1、(2分)
下列离子方程式表示错误的是( )
( A )向溴化亚铁中通入氯气2Fe2++Cl2==2Fe3++2Cl–
( B )将氯气通入澄清石灰水中Cl2+OH–=Cl–+ClO–+H+
( C )铝片放入NaOH溶液中2H2O+2Al+2OH–==2AlO2–+3H2
( D )在氯化铵溶液中滴入水玻璃2NH4++SiO32–+H2O==2NH3+H2SiO4¯
2、(2分)
在标准状况下,将CO2和CO的混和气体(密度为![]() 克/升)充满一盛有足量Na2O2的容器(容积为22.4升)中,用间断的电火花引发至充分反应。反应完成后对容器里存在的物质叙述正确的是( )
克/升)充满一盛有足量Na2O2的容器(容积为22.4升)中,用间断的电火花引发至充分反应。反应完成后对容器里存在的物质叙述正确的是( )
( A )0.5摩CO ( B )0.125摩O2 ( C )0.25摩Na2CO3 ( D )0.5摩Na2CO3
3、(2分)
物质的量相同的两份铜粉,一份在空气中加热,完全变为CuO后再加稀硝酸,使之刚好完全溶解。另一份直接用浓硝酸使之完全溶解,前者与后者消耗硝酸的物质的量的比是( )。
( A )4∶3 ( B )1∶1 ( C )2∶1 ( D )1∶2翰林汇
4、(2分)
在相同状况下,将下列四组混合气体:(a)体积比为3∶1的NH3、N2,(b)体积比为1∶1的NO、NO2,(c)体积比为1∶1的NO2、O2,(d)体积比为4∶1的NO2、O2分别置于等容积等长度的试管里,并将试管倒置于水槽中。充分反应后,液面上升的高度分别为h1、h2、h3、h4,则( )
( A )h1>h2>h3>h4 ( B )h4>h3>h2>h1
( C )h4>h1>h3>h2 ( D )h1>h3>h2>h4
5、(2分)
将纯净的过氧化钠投入87.6克水中,当全部反应后,收集到2240毫升(标准状况)的气体,所得溶液的质量分数是( )。
( A )15% ( B )16% ( C )18% ( D )20%
6、(2分)
在AgNO3和Cu(NO3)2的混和溶液中,加入一定量的铁粉,充分反应后有少量金属析出,过滤后,向滤液中滴加盐酸,有白色沉淀生成。则析出的少量金属是( )
( A )Cu和Ag ( B )Cu ( C )Ag ( D )Fe和Ag
7、(2分)
现有四种无色溶液NaCl、Na2SO4、NaHCO3、Na2CO3,又有四种试剂(a)AgNO3、(b)BaCl2、(c)H2SO4、(d)稀盐酸。若分别检验出四种无色溶液,应选择的试剂是( )
( A )(a)(d) ( B )(a)(c) ( C )(b)(d) ( D )(b)(c)
8、(2分)
加热8克某晶体,除去结晶水后剩下5.7克固体残余物。该残余物的组成以氧化物形式表示含Fe2O340%和SO360%,残余物溶于水后遇Ba2+,可生成不溶于酸的白色沉淀。则原来的晶体的化学式是( )
( A )FeSO4·7H2O ( B )Fe2(SO4)3·5H2O
( C )Fe2(SO4)3·7H2O ( D )Fe2(SO4)3·9H2O
9、(2分)
将47%的硝酸200克加入23%的硝酸( )克中,可得到39%的硝酸。
( A )50 ( B )150 ( C )100 ( D )75
10、(2分)
下列变化,不能一步达成的是( )。
( A )SO2®S ( B )N2®NO2 ( C )H2SO4®SO2 ( D )H2S®SO2
11、(2分)
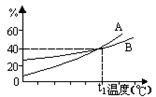
|
|
右图是A、B两种物质饱和溶液的质量分数随温度变化的曲线,现分别将50克A和80克B加入150克水中,加热溶解并都蒸去50克水后,冷却至t1°C,下列叙述正确的是( )
( A )t1°C时溶液中A、B的浓度相等
( B )t1°C时溶液中A的浓度小于B
( C )t1°C时二者均无固体析出
( D )t1°C时析出固体B
12、(2分)
反应:11P+15CuSO4+24H2O®5Cu3P+6H3PO4+15H2SO4发生时,6.02´1023个Cu2+能氧化P的物质的量是( )
( A )![]() 摩 ( B )
摩 ( B )![]() 摩 ( C )
摩 ( C )![]() 摩 ( D )
摩 ( D )![]() 摩
摩
13、(2分)
由A、B两种气体组成的混和气体,分子量A为MA,B为MB,已知在混和气中A的质量百分比为m%,则该混和气体的平均分子量为( )。
( A )MA×m%+MB(1-m%)
( B )![]()
( C )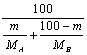 ( D )无法计算翰林汇
( D )无法计算翰林汇
14、(2分)
能正确表示下列反应的离子方程式是( )
( A )在硫酸氢钠溶液中加入氢氧化钡溶液至PH值=7:Ba2++2OH–+2H++SO42–=BaSO4¯+2H2O
( B )在沸水中滴加饱和FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3¯+3H+
( C )等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合:2HCO3–+Ba2++2OH–=BaCO3¯+2H2O+CO32–
( D )将3.2克铜片加入80毫升2.5摩/升的硝酸溶液中:Cu+4H++NO3–=Cu2++2H2O+NO
15、(2分)
甲、乙两人在室温时,各取50克A溶液,分别做结晶实验,甲将溶液蒸发掉10克水后,冷却至室温得晶体1克,乙将溶液蒸发掉20克水后,冷却至室温,得晶体6克,(两次晶体均不含结晶水)。若两人的实验结果都正确,则物质A在室温时的溶解度为( )
( A )10克 ( B )30克 ( C )50克 ( D )35克
16、(2分)
在t℃50克某物质溶液加热蒸发5克水后恢复到t℃,有2克某物质(不含结晶水,下同)析出,再蒸出5克水恢复到t℃,又析出某物质3克,则t℃时某物质的溶解度是( )
( A )40克 ( B )50克 ( C )80克 ( D )60克
17、(2分)
向5毫升NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴碘化钾溶液,沉淀变为黄色,再加入一滴硫化钠溶液,沉淀又变成黑色,根据上述变化过程,分析这三种沉淀物的溶解度关系为( )
( A )AgCl=AgI=Ag2S ( B )AgCl<AgI<Ag2S
( C )AgCl>AgI>Ag2S ( D )无法判断
18、(2分)
某温度下,在100克水中加入m克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合( )
( A )m=![]() n ( B )m=
n ( B )m=![]() ( C )m=
( C )m=![]() ( D )m=
( D )m=![]()
19、(2分)
Cl2与NH3在一定条件下发生反应:3Cl2+8NH3=N2+6NH4Cl。被15升Cl2氧化的NH3(相同条件)的体积是( )
( A )10升 ( B )20升 ( C )30升 ( D )40升
20、(2分)
某金属氧化物的化学式为MxOy,那么该金属氯化物的化学式为( )
( A )MCl![]() ( B )MCl
( B )MCl![]() ( C )MxCly ( D )MyClx翰林汇
( C )MxCly ( D )MyClx翰林汇
21、(2分)
还原金属M的氧化物2.32克,得到1.68克金属,如果M的原子量为56,这种氧化物的化学式为( )
( A )M2O ( B )MO2 ( C )M2O3 ( D )M3O4
22、(2分)
下列关于分子的叙述正确的是( )
( A )物质都是由分子组成的,分子是组成物质的最小微粒
( B )每个分子式都只能表示一种物质
( C )6.02![]() 1023个某物质分子的质量和即为该物质的式量
1023个某物质分子的质量和即为该物质的式量
( D )两种物质式量之比等于它们的分子质量之比
23、(2分)
将PH=2的盐酸和PH=12的氨水(电离度为2%)等体积混合后,溶液中浓度关系正确的是( )
( A )[Cl-]>[NH4+]>[H+]>[OH-] ( B )[NH4+]>[OH-]>[Cl-]>[H+]
( C )[NH4+]>[Cl-]>[OH-]>[H+] ( D )[Cl-]>[H+]>[NH4+]>[OH-]
24、(2分)
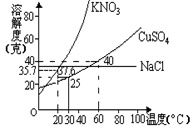 右图是几种盐的溶解度曲线,下列说法正确的是( )
右图是几种盐的溶解度曲线,下列说法正确的是( )
( A )40°C时,将35克食盐溶于100克水中,降温至0°C,可析出氯化钠晶体
( B )20°C时,硝酸钾饱和溶液的质量百分比浓度为37.6%
( C )60°C时,200克水中溶解80克硫酸铜达饱和,当降温至30°C时,可析出30克硫酸铜晶体
( D )30°C时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠
二、填空题
1、(5分)
将4克NaOH和11.2克KOH溶于水,制成500毫升溶液,此溶液中OH-的物质的量浓度是________;溶液中Na+与K+的个数比是________;中和此碱溶液100毫升需2摩/升的盐酸________毫升,如改用2摩/升的磷酸,则需________毫升。
2、(5分)
有一种无色混合气体,它可能由SO2、CO2、NH3、H2S、H2、NO、Cl2组成。若将混合气体通过盛有吸湿五氧化二磷的干燥管,体积无变化,再通过盛有浓硫酸的洗气瓶,浓硫酸中出现混浊,剩下气体通过盛有碱石灰的干燥管,气体体积减小,把最后残余的气体在空气中点燃,产生浅蓝色的火焰。若将盛原混和气体的容器打开盖,无明显现象,则原混合气体中含有___________________________。
3、(5分)
多硫化物Sx2-(x=2~6)在碱性溶液中被BrO![]() 氧化为SO
氧化为SO![]() ,而BrO
,而BrO![]() 被还原为Br-;在反应中,消耗BrO
被还原为Br-;在反应中,消耗BrO![]() 和OH-的物质的量之比为2∶3,则x值为______,其反应的离子方程式为_______。
和OH-的物质的量之比为2∶3,则x值为______,其反应的离子方程式为_______。
4、(5分)
有物质的量浓度相同的下列三种溶液:
(a)H2CO3 (b)Na2CO3 (c)NaHCO3
(1)三种物质中, 是共价化合物。
(2)三种物质中, 对热最稳定; 对热最不稳定。
(3)二氧化碳分别通过三种溶液,气体体积减小最多的是 。
(4) 中[CO32-]最大; 中[CO32-]最小。
(5) 的PH值最小; 的PH值最大。
(6)三种物质中, 一级电离是不可逆的,二级电离是可逆的。
(7) 既能与盐酸反应,又能与氢氧化钡溶液反应。
5、(5分)
反应混和物A、B、C的物质的量浓度与时间t(秒)关系如表所示,该反应方程式为_______用A浓度变化表示200~800秒内反应的平均反应速度为___________摩/升·分。
| T | 200 | 400 | 800 |
| A | 1.45 | 1.28 | 1.00 |
| B | 0.38 | 0.72 | 1.28 |
| C | 0.095 | 0.18 | 0.32 |
6、(5分)
测定水中溶解氧气的方法是:量取a毫升水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡,使反应均匀。打开塞子,迅速加入适量H2SO4,此时有I2生成,用Na2S2O3溶液(浓度为b摩/升)和I2反应,消耗了V毫升(以淀粉为指示剂),有关反应为:
2Mn2++O2+4OH-===2MnO(OH)2(反应很快)
MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
I2+2S2O![]() ====S4O
====S4O![]() +2I-
+2I-
(1)试求水中溶解O2的量(以毫克/升为单位)。
(2)I2和S2O![]() 反应时以淀粉为指示剂,达到终点时溶液的颜色如何变化。
反应时以淀粉为指示剂,达到终点时溶液的颜色如何变化。
(3)加MnSO4及含KI的NaOH溶液振荡后,若塞子未塞紧(未溅出溶液),测得的结果将会如何?为什么?
7、(5分)
在2升的密闭容器中放入4.2摩N2O5,发生2N2O5![]() 4NO2+O2的反应。反应5分钟后,N2O5减少到3.4摩。求
4NO2+O2的反应。反应5分钟后,N2O5减少到3.4摩。求![]() 、
、![]() 、
、![]() 分别是多少?翰林汇
分别是多少?翰林汇
三、简答题
1、(5分)
在FeCl3溶液中,分别加入铁粉、铜粉和镁粉,能否发生反应?若能反应,写出反应现象和化学方程式,并作简要解释。
2、(5分)
有人误将153克蔗糖和300克食盐混在一起,已知20℃时氯化钠的溶解度为36克,蔗糖的溶解度为204克,现用过滤的方法进行分离,试计算在该温度下至少应加进多少克水才能取出最多的氯化钠。能否用更少的水取得更多的食盐,如果可能采用什么办法。
四、计算题
1、(7分)
一定温度下,在135克CuSO4溶液中,取出![]() ,加入5克无水CuSO4恰好达到饱和,在剩下
,加入5克无水CuSO4恰好达到饱和,在剩下![]() 的CuSO4溶液中,加入过量的铁粉,待反应完全后,测得溶液的质量为89.5克。
的CuSO4溶液中,加入过量的铁粉,待反应完全后,测得溶液的质量为89.5克。
(a)求原135克CuSO4溶液是由多少克CuSO4晶体和多少克水配制而成的?
(b)求该温度下CuSO4的溶解度。
![]()
【试题答案】
一、选择题
1、(2分) AB 2、(2分) B 3、(2分) D 4、(2分) C
5、(2分) B 6、(2分) C 7、(2分) CD 8、(2分) D
9、(2分) C 10、(2分) B 11、(2分) BD 12、(2分) C
13、(2分) C 14、(2分) A 15、(2分) C 16、(2分) D
17、(2分) C 18、(2分) B 19、(2分) A 20、(2分) B
21、(2分) D 22、(2分) D 23、(2分) C 24、(2分) D
二、填空题
1、(5分)
0.6摩/升;1:2;30;10
2、(5分)
CO2、H2S、H2
3、(5分)x值为5
3S![]() +16BrO
+16BrO![]() +24OH-==15SO
+24OH-==15SO![]() +16Br-+12H2O
+16Br-+12H2O
4、(5分)
(1)(a) (2)(b);(a) (3)(b) (4)(b);(a) (5)(a);(b) (6)(c) (7)(b)(c)
5、(5分) 2A=4B+C、0.045
6、(5分)
(1)![]() 毫克/升。(2)由蓝色变无色。(3)结果将会偏高,因有空气进入,增大了O2的量。
毫克/升。(2)由蓝色变无色。(3)结果将会偏高,因有空气进入,增大了O2的量。
7、(5分)
![]() =0.08摩/升·分、
=0.08摩/升·分、![]() =0.04摩/升·分、
=0.04摩/升·分、![]() =0.16摩/升·分翰林汇
=0.16摩/升·分翰林汇
三、简答题
1、(5分)
向FeCl3溶液中分别加入铁粉、铜粉和镁粉。铁和铜发生的主要是氧化还原反应;镁和它的反应则主要与水解作用有关。
加入铁粉时,可看到铁粉缓慢溶解,溶液颜色由黄色变为浅绿色,其反应为:2FeCl3+Fe===3FeCl2
加入铜粉时,可看到铜粉缓慢溶解,溶液由黄色变为蓝绿色,其反应为:2FeCl3+Cu===2FeCl2+CuCl2
加入镁粉时,可看到有红棕色沉淀和气泡生成,这是由于FeCl3溶液存在如下水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl。加入镁粉,Mg和水解出的HCl发生置换反应,放出H2,其反应为Mg+2HCl===MgCl2+H2á,使水解平衡向正方向移动,所以有红棕色沉淀产生。
Fe(OH)3+3HCl。加入镁粉,Mg和水解出的HCl发生置换反应,放出H2,其反应为Mg+2HCl===MgCl2+H2á,使水解平衡向正方向移动,所以有红棕色沉淀产生。
总反应方程式:2FeCl3+6H2O+3Mg===2Fe(OH)3â+3H2á+3MgCl2
翰林汇
2、(5分)
由于蔗糖的溶解度比食盐大,只要加进使蔗糖全部溶解的水量,而氯化钠只能溶解一小部分,这时过滤就可将未溶的氯化钠取出。设20℃时溶解153克蔗糖需水x克。
则204∶100=153∶x,解之,x=75(克)
设75克水在20℃能溶解氯化钠y克。
则36∶100=y∶75 解之,y=27(克)
未溶解的食盐为300-27=273(克)
由于蔗糖的溶解度随温度升高而很快增大,而氯化钠的溶解度受温度影响很小,因此用加热的方法,可以用少量的水得到更多的氯化钠。翰林汇
四、计算题
1、(7分)
(a)23.44克,111.56克;(b)25克