高三化学强化训练题
第一部分选择题 (共68分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
2.恒温恒压下,在容积可变的器皿中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A. 不变 B. 增大 C. 减少 D. 无法判断
3、关于溶液的酸碱性说法正确的是
A.c(H+)很少的溶液一定呈碱性。 B.c(H+)=c(OH-)的溶液一定呈中性
C.pH等于7的溶液一定呈中性。 D.不能使酚酞试液变红的溶液一定呈酸性
4、某温度下,在密闭容器中发生如下反应: 2A(g)+ B(g) ![]() 2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为
2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为
A.20% B.40% C.60% D.80%
5、下列有关实验室一般事故的预防和处理方法正确的是
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.少量酸或碱滴到实验台上,立即用湿抹布擦净,再用水冲洗抹布
C.金属钠着火时,可用干粉灭火器来扑灭
D.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却
6、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
7、将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A. 稀硝酸 B. 硝酸铜 C. 稀盐酸 D.氢氧化钠
8、有关晶体的下列说法中正确的是
A.氯化钠熔化时离子键未被破坏。 B.原子晶体中共价键越强,熔点越高
C冰融化时水分子中共价键发生断裂。D.晶体中分子间作用力越大,分子越稳定
二。选择题(本题包括11小题,每小题4分,,共44分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9. pH相同,体积也相同的稀硫酸与醋酸溶液,分别同时与过量的锌粒反应,则下列叙述正确的是
A. 开始时产生氢气的速率 v (H2SO4)>v (CH3COOH)
B. 开始时产生氢气的速率 v (H2SO4)<v (CH3COOH)
C. 经过tmin时,产生氢气的速率 v (H2SO4)<v (CH3COOH)
D. 最终产生氢气的量 n (H2SO4)<n (CH3COOH)
10.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈垦酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
 C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
11.用NA表示阿伏加德罗常数,下列说法中正确的是
A.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
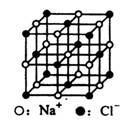
C.23.4gNaCl晶体中含有0.1NA个右图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
12.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。试组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3-
C.Fe2+、Na+、SO42-、NO3- D.Mg2+、NH4+、SO42-、Cl-
13.巳知25℃、l0lkPa下,石墨、金刚石燃烧的热化学方程式分别为;
C(石墨)+O2(g)=CO2(g);△H=—393.51kJ/mol
C(金刚石)+O2(g)=CO2(g);△H=-395.4l kJ/mol 据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小 B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高 D.由石墨制备金刚石—定是吸热反应
14.下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钠溶液与明矾溶液混合:
Ba2++3OH-+Al3++ SO42-=BaSO4↓+Al(OH)3↓
B.向苯酚钠溶液中通人少量CO2:C6H5O-+CO2+H2O→C6H5OH↓+HCO3-
C.向硫代硫酸钠溶液中滴人过量稀硫酸:4H++2S2O32-=3S↓+ SO42-+2 H2O
|
15.下列方案合理的是
A.用饱和碳酸钠溶液来除去乙酸乙酯中混有乙酸、乙醇杂质;
B.用NaOH溶液除去溴乙烷中混有的Br2;
C.用通入O2来除去二氧化氮中少量的一氧化氮;
D.用滴加BaCl2溶液的方法除去Na2SO3溶液中的Na2SO4
16.下列有关物质的结构或性质的叙述错误的是
A.水是一种非常稳定的化合物,这是由于氢键所致
B.由极性键形成的分子不一定是极性分子
C.H2O、HF、NH3、CH4的沸点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
17.下列实验操作中,错误的是
A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
B.制取乙酸乙酯时,导管不能插入饱和Na2CO3溶液液面以下
C.用盐酸和NaOH溶液测定中和热时,可以使NaOH稍过量
D.配制1.0 mol/L硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释
18.将2 mol A和1 mol B充人某密闭容器中发生反应:2A (g)十B (g) ![]() xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a
B、若在恒温恒容下,当x=2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为a
C.若在恒温恒压下,当x=3时,1 mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x为2或3
19.某二元酸(H2A)按下式发生电离:H2A=H++HA—;HA—![]() H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
A.四种溶液中c(H+)的关系:①>②>③>④
B.四种溶液中离子总数的关系:④>③>②>①
C.在②的溶液中一定有:c<(Na+)>c (HA—)>c (OH—)>c (H+)
D.在①的溶液中:c (H+)=c(HA—)+c (A2—)+c (OH—)
第二部分 (非选择题 共82分)
三、(本题包括2小题,共20分)
20.(5分)(1)用焰色反应检验NaOH溶液中的钠元素时,在用铂丝蘸取NaOH溶液之前必须进行的操作是________________________________ 。
确保该实验能成功进行的关键因素是____________________、__________________________、_____________________________。
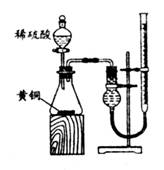 21.(15分)现有某黄铜(铜、锌合金)的颗粒状样品约100mg,李洋同学将样品分为两等份,首先用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原于质量。回答下列问题:
21.(15分)现有某黄铜(铜、锌合金)的颗粒状样品约100mg,李洋同学将样品分为两等份,首先用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原于质量。回答下列问题:
(1)加入稀硫酸和黄铜中的锌完全反应,应如何操作?
_________________________________________________________________________;反应前、后碱式滴定管中的液面高度与干燥管中的液面高度均应保持相同,反应充分进行后,如何使碱式滴定管中的液面高度与干燥管中的液面高度相同?
___________________________________________ 。
(2)为了保证实验结果的准确,请你将本实验过程中需直接测定的有关物理量填人下表中
(用文字说明,不必填满):
| ① | ② | ③ | ④ | ⑤ | ⑥ |
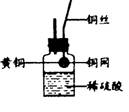 (3)李洋同学还想改用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原子质量。
(3)李洋同学还想改用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原子质量。
①该实验过程中,必须对反应后所剩的固体进行洗涤、干燥,如何确保所得固体是干燥的?
__________________________________________________
②陆老师组织班级同学从该实验装置、中学化学实验室的现有条件两方面,对该实验方案的可行性进行评价,请你参与讨论,并发表你的看法。
___________________________________________________________________________________________________________________________________________ 。
四.(本题包括2小题,共20分)
22.(10分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:
。
(2)Be(OH)2与Mg(OH)2可用 试剂鉴别,其离子方程式为:
。
(3)BeCl2是 化合物。(填“离子”或“共价”)
(4)Li与Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是
。
23、(共10分)A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,D、E均为无色气体,H为不溶于酸的白色沉淀。各物质的转化关系如下图所示:
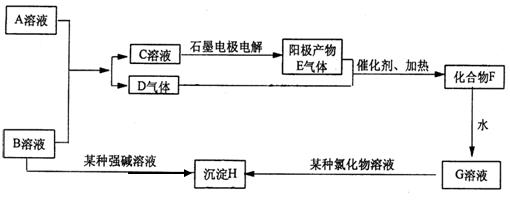 1)化学式:A_______________ B.____________
1)化学式:A_______________ B.____________
2)C溶液电解时,阳极电极反应方程式_______ ________
3)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式
___________________________________________________________
4) A与B溶液混合时发生反应的离子反应方程式
回答以下问题:
1)化学式:A_______________ B.____________
2)C溶液电解时,阳极电极反应方程式_______ ________
3)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式
___________________________________________________________
4) A与B溶液混合时发生反应的离子反应方程式
___________________________________________________________
五.(本题包括2小题,共18分)
24.(8分)现有A、B、C、D四种有机物,已知:
①它们的相对分子质量都是104;
②A是芳香烃,B、C、D均为烃的含氧衍生物,分子内均没有甲基;
③A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(方程式未注明条件):
nA→X; nB→Y(聚酯)+nH2O; nC+nD→Z(聚酯)+2nH2O
请按要求填空:
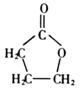
(1)A的结构简式是______________,A分于中处于同一平面的原子最多有_______个;
(2)B也能发生分子内酯化生成五元环状化合物E,E的结构筒式是______________:
(3)Z的结构简式是____________________________________________________。
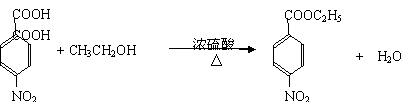
25.(10分)根据下面的反应路线及所给信息填空。
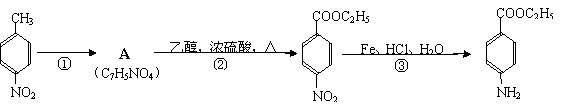 |
(苯佐卡因)
(1)① 的反应条件是: 。② 的反应类型是:
(2)反应②的化学方程式:
。
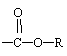 |
(3)苯佐卡因有多种同分异构体,其中—NH2直接连在苯环上,分子结构中含有
 官能团,且苯环上的一氯取代物只有两种的同分异构体共有六种,除苯佐卡因外,其中两种的结构简式是:
官能团,且苯环上的一氯取代物只有两种的同分异构体共有六种,除苯佐卡因外,其中两种的结构简式是:
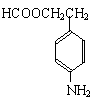 |
、
则剩余三种同分异构体的结构简式为:
、 、 。
六、(20分)
26.(10分)测量PbCl2在常温下的溶解度过程如下:①将1.00PbCl2加入100mL的蒸馏水中,搅拌使其溶解达饱和状态(假设溶液的密度为1.00g/mL);②用滤纸(质量为1.00g)过滤,用5mL冰水将滤纸和滤出的PbCl2沉淀洗涤数次,现用2mL~33mL丙酮洗涤数次;③将干燥后的PbCl2及滤纸称量,共重1.44g。回答下列问题:
(1)计算PbCl2的溶解度。
(2)计算饱和PbCl2溶液中Cl-的物质的量浓度。
(3)如用温水洗涤PbCl2沉淀,对测量结果有什么影响?
(4)用丙酮洗涤的目的是?
27.(10分)已知Na2O和Na2O2的混合物109mg和足量水作用,得到300mL溶液,其中含溶质120mg。试计算:
(1)原混合物中Na2O和Na2O2的质量各为多少?常温下所得溶液的pH。
(2)若Na2O和Na2O2的混合物质量为w g ,和足量水作用后得到的溶液中,所含溶质的质量较原混合物增加了a g,试写出a的数值大小范围(以含w的代数式表示)。
高三化学强化训练题参考答案
一、(本题包括8小题,每小题3分,共24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | A | B | C | B | A | B | B |
二、(本题包括11小题,每小题4分,共44分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | CD | A | AC | BC | D | B | A | A | D | BD | A |
三、(共20分)
20.(5分)把铂丝用盐酸洗涤后灼烧(1分),反复多次,直至火焰变为无色(1分) 铂丝要洗净,避免其它离子的干扰(1分)、酒精灯芯不被污染(1分)、待测溶液的浓度不能太小(1分)
21、(15分)(1)将分液漏斗上的玻璃塞拔掉[或使塞上的小孔(凹槽)对准漏斗的小孔(凹槽)] (1分),旋转活塞,使稀硫酸滴人锥形瓶中(1分) 慢慢将碱式滴定管向下移动(1分)
(2)①反应前后锥形瓶内固体的质量(2分) ②反应前后滴定管内液面的刻度(2分) ③实验时室内的温度和压强(也可分开填写) (2分)
(3)①干燥剩余固体,冷却、称量,至两次称量质量相等(2分) ②由于缺少干燥氢气的装置;实验测得的锌的相对原子质量偏小;实验中所测质量或质量变化值很小,托盘天平的精度较差,达不到称量要求。(或其他合理答案)(4分)
四、(本题包括2小题,共20分)
22.(10分)
(1)Be+2OH-====BeO22-+H2↑ (2分)
(2)NaOH溶液 Be(OH)2+2OH-====BeO22-+2H2O (各2分,共4分)
(3)共价 (2分)
(4)Li2O (2分)
23.(共10分)(1)A: NaHSO3 B: NaHSO4
(2)4OH—–4e-=== 2H2O+ O2 ↑
(3)SO42-+ 2H+ + Ba2+ +2 OH— == BaSO4↓ +2 H2O
(4)HSO3- +H+ == SO2↑ + H2O
五、(本题包括2小题,共18分)
23、(共8分每空2分)(1) 16
16
(2) (3)
(3)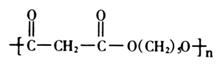
24.(10分)
(1)KMnO4(H+), 酯化反应(或取代反应) (各1分,共2分)
 (2)
(2)
( 2分)
(3)
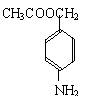 | 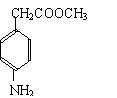 | 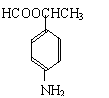 |
(各2分,共6分)
六、(20分)
26.(10分)
(1)溶液水的PbCl2的质量=1 .00—(1.44g-1.00g)=0.56g(1分)
PbCl2的溶解度=0.56g(1分)
(2)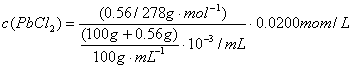 (3分)
(3分)
c(Cl-)=0.0400mol/L(1分)
(若体积直接用0.1L,则扣2分,单位或结果的有效数字出错共扣1分)
(3)使沉淀量减少(1分),测得溶解度结果偏大;(1分)
(4)丙酮易挥发(1分),可使PbCl2沉淀和滤纸较易干燥(1分)
27.(10分)(1)设Na2O的物质的量为x,Na2O2的物质的量为y
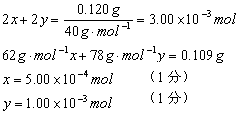 Na2O+H2O===2NaOH
Na2O+H2O===2NaOH
x 2x
2Na2O2+2H2O===4NaOH+O2↑
y 2y
故 m(Na2O) = 62g·mol-1×5.00×10-4mol = 0.031g = 31.0 mg (1分)
m(Na2O2) = 78g·mol-1×1.00×10-3mol = 78.0 mg (1分)
![]()
(1分)
故:pH=12 (1分)
(2)Na2O+H2O===2NaOH 增重
62g 80g 18g
wg ag
2Na2O2+2H2O=== 4NaOH+O2↑ 增重
78g 80g 2g
wg ag
所以当wg全为Na2O时, a=9w/31; (1分)
当wg全为Na2O2时, a=w/39。 (1分)
现在为Na2O和Na2O2的混合物,故a数值范围为:
