高三化学定量实验
☆双基知识
一、硫酸铜晶体中结晶水含量的测定
1、实验原理
硫酸铜晶体是一种比较稳定的结晶水合物,当加热到258℃左右结晶水全部失去,据加热前后的质量差,可推算出其晶体的结晶水含量。
![]() 设硫酸铜晶体为CuSO4·x H2O
设硫酸铜晶体为CuSO4·x H2O
2、实验步骤——“四称”、“两热”
(1)称坩埚(W1 g)
(2)称坩埚及晶体的质量(W2 g)
(3)加热至晶体完全变白
(4)冷却称重(W3 g)
(5)再加热
(6)冷却称重(两次称量误差不得超过0.1g )
![]() (7 ) 计算(设分子式为CuSO4·x H2O )
(7 ) 计算(设分子式为CuSO4·x H2O )![]()
3、注意事项
(1)称前研细(2)小火加热(3)在干燥器中冷却
(4)不能用试管代替坩埚(5)加热要充分但不“过头”(否则CuSO4 也会分解)
二、中和滴定
1、实验原理:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
x元酸和y元碱恰好中和时
xc酸V酸=yc碱V碱
2、中和滴定的关键
a 准确测定参加反应的酸、碱的体积。即V标与V未——使用比较精确的测量体积的仪器:滴定管
b 准确判断中和反应是否恰好完全进行——借助指示剂完成。
c 确保实验过程中维持酸或碱的浓度不变。
3、实验步聚
(1)滴定前的准备工作
①用蒸馏水洗涤滴定管;②检查滴定管是否漏水;③用标准液润洗酸式滴定管;④取标准盐酸溶液,使液面在“0”刻度以下⑤用待测液润洗碱式滴定管;⑥取待测定NaOH溶液,使液面在“0”刻度以下。
以上操作均要注意逐出气泡。
(2)滴定步骤
①取标准盐酸溶液:用标准液润洗酸式滴定管1~2次;注入标准液至“0”刻度线以上;将滴定管固定在滴定管夹上;迅速转动活塞将尖嘴气泡排净并调整液面在“0”刻度以下。记下准确读数。
②取待测NaOH溶液:用待测液润洗碱式滴定管1~2次;注入待测液至“0”刻度以上;将滴定管固定在滴定管夹上;迅速挤压玻璃球将尖嘴气泡排出并调整液面在“0”刻度以下。记下准确读数。往洁净的锥形瓶内注入25.00mL碱液。
③向装有NaOH溶液的锥形瓶中滴入2滴甲基橙试液。
④用标准盐酸滴定:左手控制酸式滴管旋塞右手拿住锥形瓶瓶颈,边滴边不断摇动;眼睛注视锥形瓶内溶液颜色的变化。
⑤当看到锥形瓶中溶液颜色由黄色突变为无色且半分钟不恢复时,停止滴定。准确记下读数,求得滴定用去的盐酸体积。
⑥把锥形瓶里的溶液倒掉,用蒸馏水把锥 形瓶洗干净,按上述操作重复一次。
⑦取两次测定数值的平均值计算待测NaOH 的物质的量浓度。
| 滴定次数 | 待测碱溶液体积 | 标准酸溶液的体积(mL) | ||
| mL | 滴定前 | 滴定后 | 体积 | |
| 第一次 | ||||
| 第二次 | ||||
4、终点判断
当滴入最后一滴标准液,溶液颜色发生突变,且半分钟不再变化。
|
 | 酚酞 | 甲基橙 | ||||||||||||||||
| 强酸滴定强碱 | 红色 →无色 | 黄色 → 橙色 | ||||||||||||||||
| 强碱滴定强酸 | 无色 →浅红色 | 红色→橙色 |
三、硝酸溶解度的测定
(一)溶质质量法
1、原理
硝酸钾的溶解度(S)=![]()
2、实验步骤
(1)准确称量(天平)干燥的蒸发皿的质量并记录;
(2)在恒温水浴加热下,配制硝酸钾饱和溶液;
(3)取一定量的硝酸钾饱和溶液倾入蒸发皿内,称量并记录;
(4)加热蒸发皿内溶液至干,放入干燥器内冷却后称量并记录;
(5)根据上述公式计算S;
(6)重复上述操作,取两次测定结果的平均值。
3、注意事项
(1)配制硝酸钾的饱和溶液时,必须水浴加热,便于控制温度。水浴中试管内的液面要低于水浴热水的液面。
(2)配制饱和溶液时,温度计要放入试管内,不得放入水浴中。
(3)为了保证溶液达到饱和,配制时硝酸钾晶体要稍加过量,并不断搅拌,在5min内不再溶解即可。
(4)在蒸发过程中,注意不要溅失,要彻底蒸干。
(5)蒸干后的晶体连同蒸发皿,一定要放在干燥器中冷却,再称量。
(二)温度法
1、实验步骤
(1)在托盘天平上称量硝酸钾3.5g、1.5g、1.5g、2.0g、2.5g。
(2)在大试管中加10mL蒸馏水,加入3.5g硝酸钾,在水浴中加热,边加热边搅拌至完全溶解。
(3)自水浴中拿出试管,插入一支干净的温度计,用玻璃棒轻轻地搅拌,并摩擦管壁,同时观察温度计的读数,当开始有晶体析出时立即读数并记录。
(4)把试管再放入水浴中加热使晶体全部溶解,重复(3)的操作,测出开始析出晶体的温度。对比两次读数,再重测一次。
(5)向试管中再加1.5g硝酸钾[溶质为(3.5+1.5)g=5.0g],然后重复上述(3)、(4)的操作。
(6)依(5)的操作,依次再加入1.5g、2.0g、2.5g(即溶质质量依次为6.5g、8.5g、11.0g)。记录开始析出晶体的温度(温度计不必洗涤)。
(7)根据所得数据,以温度为横坐标,溶解擀为纵坐标,绘制了同溶解度曲线图。
2、注意事项
(1)当室温不够低时,可把试管浸入冷水中冷却降温。
(2)溶液在在降温过程中,用玻璃棒轻轻搅拌溶液并摩擦管壁,以防止溶液出现过饱和状态。
☆巧思巧解
一、硫酸铜晶体中结晶水含量的测定误差分析
1、客观原因:晶体本身不纯
(1)如果晶体中含有难挥发性性杂质,m(H2O)/m(CuSO4)变小,结果偏低;
(2)实验前晶体表面有水,m(H2O)/m(CuSO4)变大,结果偏高。
2、主观原因
| 产生误差的原因 | m(H2O)/m(CuSO4)的值 | X值 |
| 称量的坩埚不干燥 | 变大 | 偏大 |
| 坩埚内附有不挥发性杂质 | 无影响 | 无影响 |
| 加热后,未放入干燥器中冷却 | 变小 | 偏低 |
| 晶体未完全变白停止加热 | 变小 | 偏低 |
| 加热温度过高,晶体部分变黑 | 变大 | 偏大 |
| 加热时有少量晶体溅出 | 变大 | 偏大 |
二、中和滴定误差分析
用标准液(盐酸)滴定待测液(NaOH)时,据:C(酸)V(酸)=C(碱)V(碱),盐酸的浓度C(酸)是已知的,取放在锥形瓶中的碱液的体积V(碱)为准确量取的,待测液浓度是否准确,取决于滴定管中读取的体积。
引起这个体积误差的原因常有:①读数②仪器洗涤③滴定管漏液④标准液不标准⑤指示剂选择不当⑥待测液的量取等。
现将常见的操作误差分析如下:
| 操作错误 | 待测值 | 理由:消耗酸的体积V(酸) |
| 未用标准液洗涤酸式滴定管 | 偏高 | V(酸)量增大 |
| 未用待测液洗涤碱式滴定管 | 偏低 | V(酸)量增小 |
| 滴定前用待测液润洗锥形瓶 | 偏高 | V(酸)量增大 |
| 滴定管尖嘴部分有气泡,滴定后消失 | 偏高 | V(酸)量增大 |
| 滴定速度过快,未摇匀,指示剂已变色 | 偏高 | V(酸)量增大 |
| 快速滴定后,立即读数 | 偏高 | V(酸)量增大 |
| 滴定前读数正确,滴定后俯视读数 | 偏低 | V(酸)量增小 |
| 滴定前读数正确,滴定后仰视读数 | 偏高 | V(酸)量增大 |
三、硝酸钾溶解度测定误差分析
原理:![]()
| 能引起误差的一些操作 | 误差因素 | S/g |
| 试管接触烧杯壁 | 温度高 | 偏大 |
| 试管内溶剂高出烧杯内的水面 | 温度低 | 偏小 |
| 温度计插在水浴之中 | 温度偏低 | 偏小 |
| 溶解时间过短 | 溶质m小 | 偏小 |
| 溶解过程没有搅拌 | 溶质m小 | 偏小 |
| 将少量固体倒入蒸发皿内 | 溶质m大 | 偏大 |
| 晶体未在干燥器内冷却 | 溶质m大 | 偏大 |
| 仰视温度计刻度 | 温度偏低 | 偏大 |
| 俯视温度计刻度 | 温度偏高 | 偏小 |
☆例题精析
【例1】 研究某一化学反应的实验装置如下图所示:
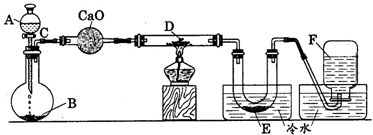 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;(1)D物质由黑色变为红色(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称: A ,B ,C ,D ,E ,F 。
2、写出有关的化学方程式:
A与B ;C与D ;
E与无水硫酸铜 ;
F与Mg ;
F与Mg的反应产物与水 。
【例2】实验室用NH3还原CuO的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO=N2+3Cu+3H2O ,试回答:
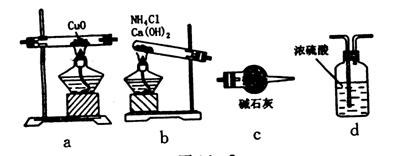 (1)如果选用测定反应物CuO 和生成物H2O
的质量时,请用下列仪器设计一个简单的实验方案。
(1)如果选用测定反应物CuO 和生成物H2O
的质量时,请用下列仪器设计一个简单的实验方案。
①仪器的连接顺序(用字母编号表示,仪器可重复使用)___________________________________________, d中浓硫酸的作用是_______________________________________ 、_________________________。实验完毕时观察到a 中的现象是_________________________________.
②列出计算铜的相对原子质量的表达式____________________________
③下列情况可使测定结果偏大的是: ( )
a CuO 未全部被还原为铜 b CuO 受潮 c CuO 中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有______________.
A m(Cu ) 和m (CuO ) B m(N2)和m(H2O )
C m(Cu)和m (H2O ) D m(NH3) 和m(CuO)
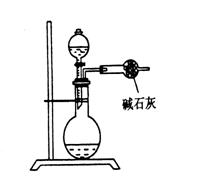 【例3】为测定工业纯碱中的Na2CO3 的质量分数(含少量NaCl),某学生设计的实验装置如图所示:
【例3】为测定工业纯碱中的Na2CO3 的质量分数(含少量NaCl),某学生设计的实验装置如图所示:
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定质量的纯碱(设为W0),并放入烧瓶中。从分液漏斗中缓缓滴入稀硫酸,待不再生成气体后,称干燥管的总质量(设为W2)。该学生导出的计算公式为:![]()
试回答:(1)W2 - W1表示什么?
(2)如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明理由并提出补救措施。
【参考答案】
【例1】1、A.浓氨水;B.氧化钙;C.氨气;D.氧化铜;E.水;F.氮气。2、CaO+NH3·H2O=NH3+Ca(OH)2 2NH3+3CuO![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
CuSO4+5H2O=CuSO4·5H2O
3Mg+N2![]() Mg3N2
Mg3N2+6H2O=3Mg(OH)2↓+2NH3
Mg3N2
Mg3N2+6H2O=3Mg(OH)2↓+2NH3
【例2】(1)①bcacd;吸收未反应的NH3 ;防止空气中水蒸气进入装置;固体由黑色变为亮红色 ② ![]() ③(a)(c) (2) A C
③(a)(c) (2) A C
【例3】(1)W2 – W1 是干燥管增加的质量,理应是CO2 的质量,但实际是CO2 和H2O的质量之和。
(2)H2O 是不多的,所以导致误差偏大的因素不大。但反应后滞留在烧瓶里(严格说还有导管里)的CO2 并未被碱石灰吸收,因而导致误差偏小的因素是相当大的。
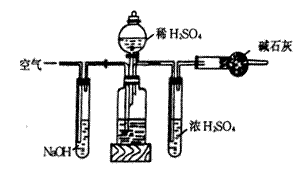 补救措施:
补救措施: