高三化学二模综合练习(二)
第Ⅰ卷(选择题 共60分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 P-31
S-32 C1-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.物质肼(N2H4)以及烷基衍生物可作为火箭的燃料,N2H4与NH3的性质有相似之处,下列关于肼的性质叙述错误的是
A.肼是二元弱减,水溶液中含有N4H5+、N2H6+、OH-、H+ B.肼有比较强的还原性
C.N2H5+不能与盐酸反应 D.肼能与水或酒精无限混合
2.下列物质使用合理的是
A 用红磷制造安全火柴 B 用加酶洗衣粉洗涤毛料服装
C 用甲醛溶液浸泡海产品 D 用体型结构的酚醛树脂制造高弹力运动鞋
3.甲、乙、丙三只烧瓶的容积相等,甲烧瓶按体积比为1:1充入NO和O2,乙烧瓶按体积比为1:1充入NO2和O2,丙烧瓶按体积比为1:1:1充入NO、NO2、O2的混合气体,将三支烧瓶都充满气体后倒置于盛有水的水槽中,当液面不再上升时,甲、乙、丙三只烧瓶中液体体积之比为
A.7:5:9 B.7:5:8 C.1:3:4 D.1:3:1
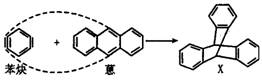
![]() 4.蒽与苯炔反应生成化合物X(X结构中三个苯环呈立体对称结构),则X中的一个氢原子
4.蒽与苯炔反应生成化合物X(X结构中三个苯环呈立体对称结构),则X中的一个氢原子
被甲基取代的所有同分异构体数为
A.2种 B.3种
C.4种 D.5种
5. 某学生选用试剂或方法区别下列各组中的物质
(1)用溴水区别苯、苯酚溶液、CCl4和乙酸;
(2)用浓盐酸区别CuO、FeS、Fe粉、MnO2和木炭粉;
(3)用水区别CCl4、乙酸、浓硫酸、乙酸乙酯;
(4)用新制的Cu(OH)浊液区别乙酸、乙醛、乙醇和甲酸;
(5)用加热和称量的方法区别CuS、Cu2S、CuO。
对该学生所选的试剂和方法的判断是:
A. 只有(2)不对 B.其中的 (3)(4)不对
C.其中的(4)(5)不对 D. 全部正确
二、选择题(本题包括10小题,每小题5分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
6.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
7.下列关于浓硝酸、浓硫酸、浓盐酸的叙述不正确的是
A.浓硝酸具有强的氧化性,常温下可与铜片迅速反应放出红棕色气体
B.将稀硫酸与铜片的混合物长时间加热,最终没有刺激性气味气体产生
C.浓盐酸与浓硝酸以体积比3︰1组成的混合物叫“王水”
D.常温下以体积比3︰1混合浓硫酸和乙醇,一段时间后溶液由无色变成棕色
8. 下列关于溶液的混合或稀释的说法中,错误的是
A.将pH=3的CH3COOH溶液加水稀释至原体积的100倍后,稀释后溶液的3<pH<5
B.将pH=4的NH4Cl溶液加水稀释至原体积的100倍后,稀释后溶液的4<pH<6
C.将pH=3的强酸溶液与pH=4的强酸溶液等体积混合后,混合溶液的3<pH<4
D.将1mLpH=3的盐酸在不断搅拌下与9mLpH=11的Na2CO3混合,则混合溶液3<pH<4
9.下列说法正确的是
A.苯酚不但比乙醇更难被氧化剂所氧化,而且苯酚比乙醇更容易发生酯化反应
B.两种不同氨基酸反应后形成的二肽只有三种
C.石油是各种烷烃、烯烃、炔烃组成的混合物
D.邻二甲苯只有一种结构,说明苯分子中不存在实际上的C—C键和C=C键
10.某学生在实验室里做气体的性质实验时,欲根据气体通入某一种物质水溶液中出现的现象作推断,其中正确的是
A.先有沉淀产生,后沉淀溶解,则该气体一定是SO2或CO2
B.先无明显现象,放置一段时间后有沉淀产生,则该气体可能为SO2或H2S
C.溶液pH值先降低,当达到7时,再通气体pH值不再降低,该气体一定为氧气
D.溶液pH先升高,后又降低到某一数值后不再降低,则该气体一定为SO2
11.下列说法正确的是
A.在熔化状态下NaHSO4的电离方程式是:NaHSO4=Na++H++SO42-
B.混合两种弱酸或者两种弱碱有可能生成强电解质
C.向平衡体系FeCl3+3KSCN![]() Fe(SCN)3+3KCl中加入KCl固体,红色变浅
Fe(SCN)3+3KCl中加入KCl固体,红色变浅
D.把桌面上直立的两支高低不等的小蜡烛点燃后再倒扣一只大烧杯,燃烧一段时间后,低的那支蜡烛先熄灭
12.某元素X的相对原子质量为a,它的最高价氧化物的水化物的分子式为HmXOn(m>1),下列叙述一定正确的是
A. 该酸水溶液中c(H+)︰c(XOnm-)=m︰1
B. 该酸的摩尔质量为(m+a+16n)g
C. 若n=m=3时,1mol该酸最多能与含3molNaOH的溶液反应
D. 若0.1mol/L该酸溶液的pH=2,则NamXOn水溶液的pH>7
13. 向含0.1mol的AlCl3溶液中分别加入15mL或者45mL烧碱溶液时,生成沉淀的质量相等,则NaOH溶液的物质的量浓度(单位:mol/L)为
A.5 B.6 C.7 D.8
14.下列关于铁及其化合物的说法中,正确的是
A. Fe和Cu以及浓硝酸组成的原电池,Fe是原电池的负极
B. 将镁粉加入FeCl3溶液中有大量的气泡和红褐色沉淀产生
C.室温下将小铁片放入浓硝酸一段时间,取出洗净后再放入CuSO4溶液中,表面有红色物质析出
D.反应Al3++3AlO2-+6H2O=4Al(OH)3↓不属于化合反应
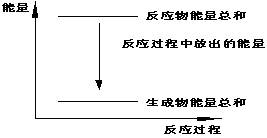 15.对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
15.对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共27分)
16.(13分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯
气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
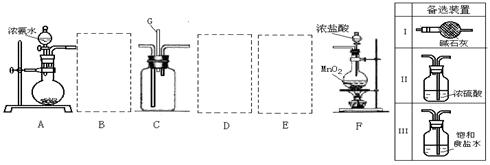
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:
。
(5)从装置C的q处逸出的尾气可能含有污染环境的气体,如何处理?
答: 。
17.(14分)目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO![]() 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO![]() 。
。
为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
![]() ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
![]() 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。
②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:_______________________ _
(3)若气体流速管中气体流速为a cm3/min,当t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)实验中棉花的作用是______________________________________________;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是
。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):
_______________________________________________________________。
四、(本题包括3小题,共33分)
18.(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。
下表是一些键能数据(KJ·mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:___________________________________;试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是_____________________________________________________,由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ·mol-1和表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
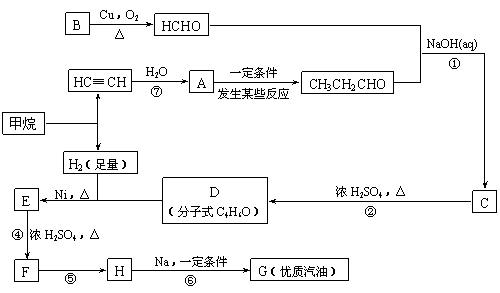
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是_________________________________。
19.(12分)物质A是化合物,B、C、D、K都是单质,反应②~⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
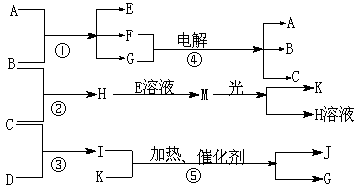
请填写下列空白:
(1)写出下列物质的化学式:B ; C ; D ;
K ;G ;J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
20.(9分)1991年Langmuir提出:“凡原子数与总电子数相等的物质,则结构相同,物理性质相近”,称为等电子原理。相应的物质,互称为等电子体.化学科学家常用“等电子体”来预测不同物质的结构与性质,例如CH4与NH4+ 有相同的电子数目及空间构形.
(1)依据等电子原理在下表空格处填写相应的化学式:
| CH4 | CO32- | C2O42- | N3B3H6 | |||
| NH4+ | N2H62+ | NO2+ | N2 |
(2)(BN) 3 是一种新的无机合成材料,它与某单质互为等电子体.工业上制造(BN) 3的方法之一是用硼砂(Na2B4O7)和尿素在1073~1273K时反应,得到α—(BN)3 及其它元素的氧化物.α-(BN)3可作高温润滑剂、电气材料和耐热的涂层材料等。如在高温高压条件下反应,可制得β—(BN)3,β—(BN)3 硬度特高,是作超高温耐热陶瓷材料、磨料、精密刃具的好材质.
①它与什么单质互为等电子体 ;
②写出硼砂和尿素的反应方式 ;
五、(本题包括2小题,共21分)
21.(9分)乙烯利是目前农业生产中普遍使用的植物生长调节剂,对促进橡胶、蔬菜、水果、棉花等的早熟均具有非常好的效果。乙烯利的工业生产是用乙烯等为原料经下列步骤进行的(其中乙烯转化为氯代乙醇有图示的两种途径):
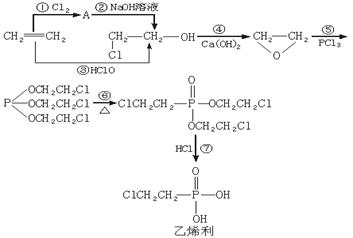
请回答下列问题:
(1)有机化学的基本反应类型有:A.加成反应 B.消去反应 C.取代反应 D.重排反应四种。其中重排反应是指像CH2=CH—OH![]()
![]() 的一类反应,即反应的过程只是原子在分子内的结合方式发生重新排列。请指出合成路线中下列反应所属的基本类型(填代号):③___________,⑥__________,⑦__________。
的一类反应,即反应的过程只是原子在分子内的结合方式发生重新排列。请指出合成路线中下列反应所属的基本类型(填代号):③___________,⑥__________,⑦__________。
(2)写出反应方程式:① ;
⑤ 。
(3)乙烯利的制取过程较好地体现了绿色化学的两个特征:原料的原子利用率高(原料中的原子尽可能多地转化到产品中),不向或少向环境中遗留副产物。如上述过程中的有机副产物(写结构简式)_______________就可以在该合成中重复利用。
22.(12分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展、人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
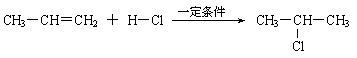
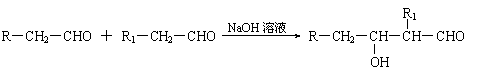 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)
⑵
 |
 ⑶
⑶
合成路线如下:
⑴在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
⑵写出下列反应方程式
E → F: ;
H → G: 。
⑶H也能与NaOH溶液反应,其反应方程式为 ,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
六、(本题包括2小题,共19分)
 23.(9分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
23.(9分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL。
①在图示坐标系中,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系图象。
②图示坐标系中,生成沉淀的最大质量是 ,沉淀恰好全部溶解时消耗CO2体积为 mL。
③原混合物中KOH的质量为 g。
(2)若KOH和Ca(OH)2以任意比例混合,总质量仍然保持1.3g不变,则消耗CO2总体积V的取值范围为(取整数) 。
24.(10分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板制成印刷线路板。现有400ml某FeCl3溶液A作为铜箔的腐蚀液,反应一段时间后,向所得溶液B中加入ag铁粉,充分反应后剩余bg固体。从滤液C中取出20.00ml(假设反应前后溶液体积不变),向其中滴入3.000mol·![]() AgNO3溶液60.00ml时,溶液中的Cl- 恰好完全沉淀。
AgNO3溶液60.00ml时,溶液中的Cl- 恰好完全沉淀。
(1)溶液A中FeCl3 的物质的量浓度为 。
(2)若向溶液B中加入铁粉后,滤液C中既含有Fe2+ 又含有Cu2+且不含Fe3+ ,则 _________(填编号)
①只有Fe剩余 ②只有Cu剩余 ③既有Fe又有Cu剩余 ④既无Fe又无Cu剩余
(3)溶液B最多可溶解铁粉的质量为 。
(4)若残留固体只有Cu,则b的取值范围是 。
(5)当a=60,b=40时,试通过计算确定剩余固体的成分及各成分的质量。写出计算过程。
参考答案
1.C 2.A 3.B 4.B 5.D
6.C 7.B 8.D 9.D 10.B 11.B 12.D 13.D 14.BD 15.D
16.(1)![]() (3分)
(3分)
(2)ABE (3分)
(3)Ⅰ、Ⅱ、Ⅲ (3分)
(4)Cl2 + 8NH3 = 6NH4Cl + N2 (3分) 取适量该白色固体与浓的氢氧化钠溶液共热,产
生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体溶于水后加硝酸银溶液,
产生不溶于稀硝酸的白色沉淀。(3分)
(5)可将尾气通过装有足量稀氢氧化钠溶液的洗气瓶后再排空。(2分)(其它合理答案也
酌情给分)
17.(14分)
(1)托盘天平、烧杯、200mL容量瓶、胶头滴管;搅拌和引流。
(说明:每空1分,共5分。顺序不对,从错误处开始不计分;搅拌和引流缺少任一个,不计分)
(2)5SO2 + 2MnO4- + 2H2O = 5SO42-+ 2Mn2+ + 4H+ (2分)
(3)![]() (2分)
(2分)
(4)防止可吸入颗粒堵塞导气管或进入酸性高锰酸钾溶液中,使测量质量不准(1分)
吸收前后颗粒吸附剂、棉花、盛放容器的总质量。(或将装置用编号表示回答,或答颗粒吸附剂、棉花、盛放容器的总质量的增加值)(2分)
(5)通入气流速率过快,二氧化硫未和酸性高锰酸钾溶液充分反应就已经被排出(2分)
18.(本题共8分)
(1)①不能 (1分) ②不能 (1分) 与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强。(1分)
218~330 KJ·mol-1 (1分)
(2)化学反应的反应热等于生成物的键能之和与反应物的键能之和的差 (1分) 吸收(1分) 4.5(1分)
(3)RI> RBr > RCl > RF(1分)
19.(12分)(1) B.Cl2 C.H2 D. N2 K. O2 G. H2O J.NO(各1分)
(2) ①H+ +ClO-= HClO、NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- (各2分)
NH4++OH- (各2分)
(3)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1(2分)
20.(9分)(1)C2H6 NO3- CO2 N2O4 C22- C6H6 (2) ①碳(以上每空1分)
②3Na2B4O7+6CO(NH2)2 =4(BN)3+3Na2O+6CO2↑+12H2O↑ (2分)
21.(本题共9分)
(1)A D C (各1分)
(2)CH2=CH2+Cl2![]() CH2Cl—CH2Cl (2分)
CH2Cl—CH2Cl (2分)
![]() +PCl3
+PCl3![]() P(OCH2CH2Cl)3 (2分)
P(OCH2CH2Cl)3 (2分)
(3)CH2ClCH2Cl (2分)
22.⑴③⑤⑦;②④
⑵
 |
⑶ 否
23.(11分)
解:(1)①
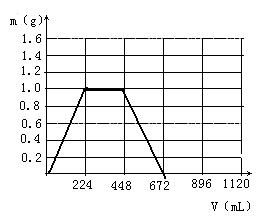 (3分)
(3分)
②1g 672 ③0.56
(2)520mL <V<787Ml
(每空2分,共8分)
24.(10分)
(1)3.000mol·![]()
(2)②或④
(3)33.6g
(4) 0<b≤38.4g
(5)解:已知a=60>33.6,说明Fe过量,剩余固体为Fe和Cu的混合物。
其中Fe的质量为m(Fe)=60g—33.6g=26.4g
Cu的质量为m(Cu)=40g—26.4g=13.6g
(每小题2分,共10分)