高三化学二模综合练习(三)
第Ⅰ卷(选择题 共60分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 P-31
S-32 C1-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR',反应式可表示为:2RCH=CHR'—→ RCH=CHR + R'CH=CHR'
现有结构简式为CH2=CHCH3和CH2=C(CH3)2的两种烯烃,发生上述的“烯烃复分解反应”,能生成多种新的烯烃。下列说法正确的是
A.生成的新烯烃共有5种
B.生成的各种新烯烃中,每个烯烃分子与HCl加成后,都只能生成一种产物
C.生成的所有新烯烃分子中,每个分子中的碳原子均共面
D.生成的所有新烯烃分子中,只有两种新烯烃分子中的碳原子共面
2.有文献报道,硫在空气中燃烧时,产物中SO3约占5% ~ 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% ~ 3%,解释这一事实的理由正确的是
A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动
B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动
C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响
D.没有使用催化剂
3.范德华根据真实气体与理想气体的差别,导出真实气体状态方程式:(P+an2/V2)(V-nb)=nRT,此方程中an2/V2项表示
A.气体分子占据的体积 B.气体分子对器壁的压强
C.器壁附近气体分子受内部气体的吸引力 D.气体分子的质量
4.如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为
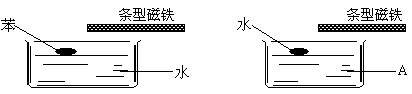
A.煤油 B. 酒精 C. 苯 D. 四氯化碳
5.下列说法可以实现的是:①酸性氧化物均能与碱发生反应;②盐溶液与弱酸反应可以生成强酸;③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;④两种酸溶液充分反应后,所得溶液呈中性;⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④⑤ B.①③④⑤ C.①②③⑤ D.①②③④⑤
二、选择题(本题包括10小题,每小题5分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
6.“对氨基苯甲酸丁酯”是防晒霜中吸收紫外线的防晒剂,下列关于“对氨基苯甲酸丁酯”的说法正确的是
A.从有机物分类看,它可属于“氨基酸类”、“酯类”、“芳香烃类”
B.它能与盐酸反应,但不能与苛性钠溶液反应
C.甲酸丁酯基(-COOC4H9)有四种不同结构
D.它的分子式为C11H16NO2
7.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3下列关系或者说法正确的是
A.c(CO32-)的大小关系为:②>⑤>③>④>①
B. c(HCO3-)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干后灼烧后只有①不能得到对应的固体物质
D.③④⑤ 既能与盐酸反应,又能与NaOH溶液反应
8.A、B、C、D、E五种短周期元素。A、B、C位于同一周期相邻位置,A和C的原子序数之比为3∶4,A、B、C分别与D形成的化合物分子中都含有10个电子。E的原子结构示意图中从内到外各层的电子数之比为1∶4∶1。则下列叙述中正确的是
A.A和C形成的某种化合物能与E的单质在一定条件下发生置换反应
B.实验室制备B、D两种元素形成的化合物发生的反应属于氧化还原反应
C.由A、C原子和B、D原子分别构成的分子都是极性分子
D.由A、B、C、D四种元素组成的化合物中不可能含有离子键
9.下列4组溶液,不用试剂也能鉴别开来的是
① AgNO3溶液、稀氨水 ② NaAlO2溶液和盐酸
③ NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl ④ NaNO3、FeCl3、NaCl、AgNO3
A.只有① B.①② C.①②③ D.全部
10.由氧化铜和氧化铁的混合物ag,加入2mol·L-1的硫酸溶液50mL,恰好完全溶解,若将a g的该混合物在H2中加热充分反应,冷却后剩余固体质量为
A.1.6a g B.(a-1.6)g C.(a-3.2) g D.无法计算
11.往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(S.T.P)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
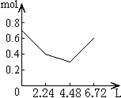
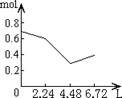
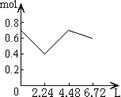
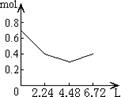
A B C D
12.在标准状况下,将CO2和CO混合气体(密度为10/7g/L)充满一盛有足量Na2O2的密闭容器中(容积为22.4L,固体体积忽略不计),用间断的点火花引发至充分反应,下列对反应完全后容器里残留物的叙述正确的是
A. 有0.125molO2 B. 有1molNa2CO3
C. 有0. 5moCO D. 有0.25molNa2CO3
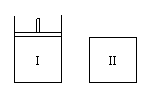 13.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?)
13.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?)![]() aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于VL
14.商品锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极反应为:
负极:C6+Li++e-→LiC6
正极:Li0.5CoO2+0.5Li++0.5e-→
LiCoO2表示锂离子电池的总反应式为:![]() 其中表示充电过程的是
其中表示充电过程的是
A.ac B.ad C.bc D.bd
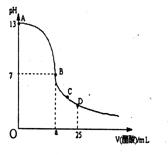 15.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,
15.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,
曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有:
c(Na+) > c(CH3COO—) > c(OH—) > c(H+)
B.在B点,a>12.5,且有:c(Na+) = c(CH3COO—) > c(OH—) = c(H+)
C.在C点:c(CH3COO—) > c(Na+) > c(H+) > c(OH—)
D.在D点:c(CH3COO—) + c(CH3COOH) == c(Na+)
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共18分)
16.(8分)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
⑴有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确? 说明理由。
⑵通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合物)
⑶在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么?
17.(10分)已知甲酸和浓硫酸共热到60~80℃可发生脱水反应:
|
HCOOH────→ CO↑+H2O
![]() 实验室用甲酸和浓硫酸混和后制取CO时,常不需加热,其具体操作方法如下:在试管内倒入一定体积的甲酸,然后再小心沿试管壁倒入等体积的浓硫酸,这时可见试管内液体分上、下两层,在两层液体的界面处有少量气泡,轻轻振动试管,可见液体交界面气泡增多,改变振动的力度可控制气泡产生的速率。试回答下列问题
实验室用甲酸和浓硫酸混和后制取CO时,常不需加热,其具体操作方法如下:在试管内倒入一定体积的甲酸,然后再小心沿试管壁倒入等体积的浓硫酸,这时可见试管内液体分上、下两层,在两层液体的界面处有少量气泡,轻轻振动试管,可见液体交界面气泡增多,改变振动的力度可控制气泡产生的速率。试回答下列问题
⑴用该法制CO不需加热的原因: 。
⑵以上操作方法可控制反应速率的原因: 。
⑶具支试管(试管侧壁有一支管,如右图所示)在实验室有多种用途,试只用具支试管、橡皮塞(橡皮塞上最多只能打一个孔)、玻璃导管及连接和夹持仪器装配一个用浓硫酸和甲酸的混合液制取CO气体,用CO还原氧化铜,并检验其氧化产物的实验装置。画出该装置示意图(同类仪器最多只有三件,不必画夹持仪器,但需注明所装的药品)
四、(本题包括3小题,共28分)
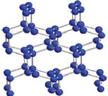 18.(10分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,D、E同主族,A、B的最外层电子数之和与C的最外层电子数相等,A、C、D的质子数之和与E的原子序数相等, A能分别与B、C 、D形成电子总数相等的分子。D、E均能形成多种同素异形体。
18.(10分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,D、E同主族,A、B的最外层电子数之和与C的最外层电子数相等,A、C、D的质子数之和与E的原子序数相等, A能分别与B、C 、D形成电子总数相等的分子。D、E均能形成多种同素异形体。
请回答:
⑴D和E的氢化物中,沸点较低的是 (写氢化物分子式)。
⑵下图为C元素的某种单质的晶体片段结构图,该晶体中每个C原子都通过三个单键与其它C原子结合并向空间发展构成立体网状结构。则该晶体属于 晶体(填原子、分子、离子等),该晶体中原子个数与共价键数之比为 。
⑶甲、乙两种盐中都含有A、B、C、D四种元素,甲盐中A、B、C、D四种元素的原子个数比为4∶1∶1∶2,将一定量的晶体物质甲,放在真空的密闭容器中加热到200℃时,甲全部分解为4种气体,其中四种气体的物质的量之比为2﹕1﹕1﹕1。若再冷却容器到一定温度时,又发现有晶体物质乙生成,此时容器中只剩一种气体,该气体未参加反应,已知该气体在相同条件下相对于氢气的相对密度为14,而且能够在空气中燃烧。
则甲的化学式为 ,乙的化学式 。
甲分解的化学方程式为 。
19.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
|
肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼
一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
20.(6分)化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。已知:
①固体A·2H2O的摩尔质量为154g/mol;
②A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
③ A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
④ A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1︰1),反应产物为A和亚硫酸钠。
⑤A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式。
(2)写出上述制备A的“分子方程式”。
五、(本题包括2小题,共24分)
21.(12分)A、B、C、D、E、F、G、H均为含有苯环的有机物。B与FeCl3溶液混合没有颜色变化,F、H除苯环外还有一个含氧的六元环(与苯环共用2个碳原子)。它们之间的转化关系如下:
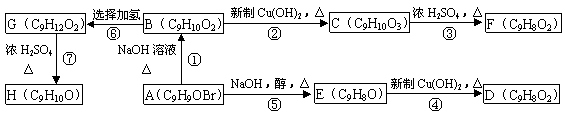 |
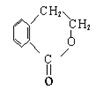
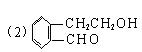
(1)化合物A含有的官能团是 。
(2)B、F的结构简式分别为 、 。
(3)物质D不可能具有的性质是 (填写字母)。
A.使溴水褪色 B.使酸性KMnO4溶液褪色 C.能与Na2CO3溶液反应
D.能发生酯化反应 E.能与新制的Cu(OH)2反应 F.能使FeCl3溶液变色
(4)反应⑤的反应类型是 。
(5)写出反应①的化学方程式: 。
(6)写出同时符合下列两项要求的C的两种同分异构体的结构简式
①化合物是1,3,5—三取代苯 ②苯环上的三个取代基中必须含有醇羟基、酚羟基和醛基这三种结构
。
22.(12分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
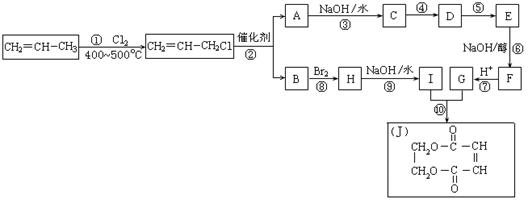
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),
设计这一步反应的目的是__________________________________________ _,
物质E的结构简式是______________ _________。
(4)反应⑩的化学方程式是________________________________________ ___。
六、(本题包括2小题,共20分)
23.(10分)在400℃、101.3kPa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积为(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
(1)通过计算说明,烃A的组成中应该满足的条件。
(2)通过计算推断,当m=27时烃A可能的分子式(写出常见的三种即可)。
(3)通过计算确定,若烃A在常温常压下为气体时,m的取值范围。
24.(10分)在酸溶液中,10.00g Cu2S和CuS的混合物与250.0mL 0.7500 mol·L-1的MnO4-反应生成了SO42-、Cu2+和Mn2+。剩余的MnO4- 恰好与175.0mL浓度为 1.000 mol·L-1的Fe2+ 溶液反应。
⑴写出所有反应的化学方程式,并配平。
⑵试计算原始混合物中 CuS 的质量分数。
参考答案
1.C 2.C 3.C 4.D 5.D
6.C 7.AD 8.A 9.D 10.B 11.D 12.AB 13.AC 14.A 15.BC
16、(6分)
(1)不正确.因为是“冷光”而不是明火。(3分)
(2)由于粘度大,反应物不易充分混合,敲打是促进混合,从而促进反应。(3分)
(3)低温使氧化反应变得十分缓慢,恢复常温时反应又加速进行。(3分)
17.(10分)
⑴甲酸和浓硫酸混合时,可产生大量的热,使反应液温度达到反应所需的温度。(2 分)
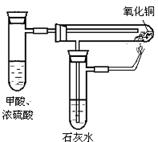 ⑵由于甲酸和浓硫酸密度不同所以甲酸在上层,浓硫酸在下层,反应在两液体的界面发生,振动试管可使两反应物相互混合、溶解,增大反应物相互间的接触面而加快反应速率。(3分)
⑵由于甲酸和浓硫酸密度不同所以甲酸在上层,浓硫酸在下层,反应在两液体的界面发生,振动试管可使两反应物相互混合、溶解,增大反应物相互间的接触面而加快反应速率。(3分)
⑶(5分)
实验装置中选用其它仪器(如酒精灯等)或所 用同类仪器超过三件的均不给分。装置基本合理,但局部有绘制错误的可酌情扣分,画出其它合理装置的参照给分。
18、(共10分)
⑴H2S(1分) ⑵原子(1分)2:3(2分) ⑶(NH4)2C2O4 (2分) (NH4)2CO3(2分)
(NH4)2C2O4
![]() 2NH3↑+H2O↑+CO↑+CO2↑(2分)
2NH3↑+H2O↑+CO↑+CO2↑(2分)
19.(共12分,每空2分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)O2+2H2O+4e-=4OH-
N2H4+4OH--4e-=4H2O+N2↑
(3)①Cu2++2e-=Cu ②112
(4)ClO-+2NH3=N2H4+Cl-+H2O
20.1.MA=32+3×16+3×1+12+23=118 118+36=154
![]() (或[HOCH2SO2]-或
(或[HOCH2SO2]-或![]() 或
或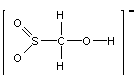 等)(3分)
等)(3分)
2.Na2S2O4+CH2O+NaOH=HOCH2SO2-Na++Na2SO3(3分)
(或Na2S2O4+CH2O+NaOH=HOCH2SO2Na+Na2SO3
或Na2S2O4+CH2O+NaOH=NaSO2CH2OH+Na2SO3)
21.(16分)
(1)—CHO、—Br(2分)
(2分) (2分)
(3)F(1分)
(4)消去反应(1分)
![]() (2分)
(2分)
(6) (2分)
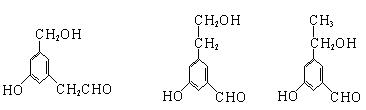 |
22.
⑴
取代反应 消去反应 加成反应
(3分)
⑵![]() (3分)
(3分)
⑶ ④ 保护A分子中C=C不被氧化 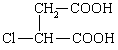 (6分)
(6分)
(4)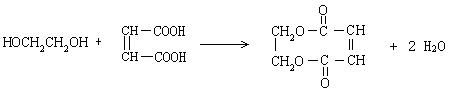 (3分)
(3分)
23.(10分)
(1)设烃的分子式为CxHy
![]() CxHy+(x+y/4)O2 xCO2+
CxHy+(x+y/4)O2 xCO2+![]() H2O 差量
H2O 差量
1
X+![]()
![]() —1 (1分)
—1 (1分)
3 (m+6)—(m—3)
列比例:1︰X+![]() =3︰[(m+6)—(m-3)]
=3︰[(m+6)—(m-3)]
y=8 ................................. (2分)
(2)当m=27时,氧气恰好完全反应,也可能过量。
所以有关系: ![]() ≥
≥![]()
解之得:x≤7 ................................. (1分)
A的可能分子式:C3H8、C4H8、C5H8、C7H8(写出其中的三个分子式就可以)
................................. (每个1分,共3分)
(3)当A常温下为气体时,则x![]() ≤4.................................(1分)
≤4.................................(1分)
![]() ≥
≥![]() . (1分)
所以:m≥18
.............. (1分)
. (1分)
所以:m≥18
.............. (1分)
24、(11分)
⑴Cu2S+2MnO4- +8H+==2Cu2+ + SO42-+ 2Mn2+ + 4H2O (2分)
5CuS+8MnO4- +24H+==5Cu2+ + 5SO42- + 8Mn2+ + 12H2O (2分)
5Fe2+ + MnO4- +8H+ === 5Fe3+ + Mn2+ + 4H2O (2分)
⑵设 Cu2S Xmol CuS Ymol
160X + 96Y == 10
![]() (3分)
(3分)
X=0.02125 Y=0.06875 W=66% (2分)