高三化学二模综合练习(五)
第Ⅰ卷(选择题 共74分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 P-31
S-32 C1-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1. 我国的“神舟五号”载人飞船己发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法不正确的是
的形式存在。下列说法不正确的是
A.![]() 原子核内含有2个质子
原子核内含有2个质子
B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有1个中子
原子核内含有1个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2.“在火星上找到水存在的证据”位居《Science》杂志评出的2004年10大科技突破之首。下列关于水的说法中错误的是
A.水是生命活动必不可少的物质
B.水是由极性键构成的极性分子
C.水是一种极弱的电解质,温度越高电离程度越大
D.高效催化剂可使水分解获得氢气,同时释放能量
3.有一位同学,在学完周期表的知识后,大胆预测了第120号元素可能具有的性质,但其预测结果不正确的是
A.该元素位于周期表中第八周期,第IIA族
B.该元素最高价氧化物对应水化物具有强碱性
C.该元素在自然界中并不存在,属人造元素,且具有放射性
D.与同族已发现的其它元素相比,该元素原子半径大密度大,熔沸点高
4.乙二酸,又称草酸,通常在空气中易被氧化变质,而其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将乙二酸滴加到浓H2SO4上使之脱水分解,分解产物是CO2和H2O
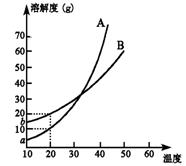 5.A、B两种化合物溶解度曲线如右图,现要求用结晶法从A、 B混合物中提取A(不考虑A、B共存时对各自溶解度的影响)。取50 g混合物将其溶于100 g热水中然后冷却至20 ℃,若要使A析出而B不析出,则混合物中B的质量分数最高不能超过( )
5.A、B两种化合物溶解度曲线如右图,现要求用结晶法从A、 B混合物中提取A(不考虑A、B共存时对各自溶解度的影响)。取50 g混合物将其溶于100 g热水中然后冷却至20 ℃,若要使A析出而B不析出,则混合物中B的质量分数最高不能超过( )
A.20% B.30% C.40% D.50%
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
6.用NA表示阿伏加德罗常数,下列叙述正确的是
A.17g氨中共价键的数目为NA
B.aL标准状况下的HCl气体的分子数为aNA/22.4
C.0.1mol/L的Na2CO3溶液中,单位体积内CO32-的个数为0.1NA/L
D.用情性电极电解NaCl溶液,每生成NaOH ag,电路中通过的电子数为a/NA
7. 能正确表示下列反应的离子方程式是
A.铜跟浓硝酸反应:Cu + 4HNO3![]() Cu2+ + 2NO3- + 2NO2↑ + 2H2O
Cu2+ + 2NO3- + 2NO2↑ + 2H2O
B.二氧化锰与浓盐酸反应(加热):MnO2
+ 4H+ + 2Cl-![]() Mn2+ + Cl2↑ + 2H2O
Mn2+ + Cl2↑ + 2H2O
C.电解硫酸铜溶液(用惰性电极):Cu2+
+ 2H2O![]() Cu + H2↑+2OH-
Cu + H2↑+2OH-
D.向硫酸铝溶液中加入小苏打:Al3+ + 3HCO3-![]() 3CO2↑+ Al(OH)3↓
3CO2↑+ Al(OH)3↓
8.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
9.口香糖中常用木糖醇做甜味剂,木糖醇可以防止龋齿,木糖醇的结构简式为![]() ,下列有关木糖醇的说法中,正确的是
,下列有关木糖醇的说法中,正确的是
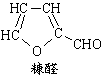 A.木糖醇是一种单糖,不能发生水解反应
A.木糖醇是一种单糖,不能发生水解反应
B.木糖醇易溶解于水,能发生酯化反应
C.木糖醇在口腔中不易被氧化为酸
D.木糖醇脱去三分子水可得糠醛(结构如右图)
10.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+ c(H+)= c(HC2O4-)+ c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)= 0.1 mol·L-1
C.c(C2O42-)> c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
11.下列说法正确的是( )
A.某二元弱酸的酸式盐NaHA溶液中: c(H+)+c(A2-)=c(OH-)十c(H2A)
B.0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合得到碱性混合溶液中:
c(Na+)> c(CN-)
C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:
c(CH3COOH)+c(CH3COO-)=0.01 mol/L22.
D.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:
c[(NH4)2SO4] > c(NH4HCO3) > c(NH4Cl)
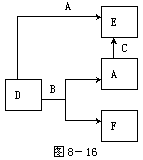
12.A、B、C分别是元素甲、乙、丙的 单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系:则下列说法不正确的是( )
A.D、E中一定都含有A的元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
13.向100 mL 2.0 mol·L-1 NaOH溶液中通入一定量H2S气体,将所得溶液低温、减压蒸干得到7.9 g固体,该固体的成分可能是
A.NaOH和Na2S B.Na2S C.Na2S和NaHS D.NaHS
14.下列说法不正确的是
A.碱金属元素的原子序数之差可能为2、8、18、32
B.已知20种氨基酸的平均相对分子质量为128,某种蛋白质由N条肽链组成,共有M个肽键,此蛋白质的相对分子质量接近于128(M十N)-18M
C.把1 mL甲醛气体溶于1 mL乙酸和1g甲酸甲酯组成的混合液中,然后加入2g葡萄糖后的混合液中碳元素的质量分数为 40%
D. ![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的离子的电子层结构相同(a、b、c、d为元素的原子序数),则
四种元素的离子的电子层结构相同(a、b、c、d为元素的原子序数),则![]()
15. 有五列同族元素的物质,在101.3KP时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 -184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne、Br2、HF
B.第②列物质均有氧化性;第③列物质对应水溶液均是强酸。
C.系列④中各化合物的稳定性顺序为:![]()
D.上表中物质HF和H2O以外,由于氢键的影响,其分子特别稳定。
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共18分)
16.(8分)Ⅰ.现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶 c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水
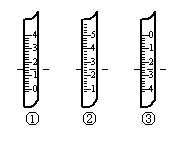 试填空:
试填空:
①如图分别是温度计、量筒、滴定管的一部分,
下述判断及读数(虚线刻度)不正确的是_______
A.①是量筒,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
②配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是 。
③除去Mg(OH)2中混有的少量Ca(OH)2:可以用的试剂是: (选填序号),操作方法是 、_______洗涤。完成③,上述仪器或用品用到的有___________(从上述仪器或用品中选择,并填上相应序号) 。
17.(10分)⑴根据初中化学知识,硫酸铜溶液与氢氧化钠溶液反应可得到蓝色沉淀,进一步将沉淀加热可生成黑色物质。小明做了这个实验:他在试管中倒入2mLCuSO4溶液,再加入一定量的氢氧化钠溶液,结果得到的沉淀并不是蓝色的,而是浅绿色的;将此浊液加热直至沸腾,观察不到有黑色CuO产生的现象。这是为什么呢?小明通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4。
①请帮小明写出生成浅绿色沉淀的有关反应的化学方程式
。
②请帮小明设计—个实验,证明该浅绿色沉淀中含有硫酸根离子
。
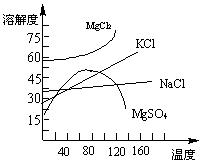 ⑵根据溶解度曲线回答下列问题:
⑵根据溶解度曲线回答下列问题:
某溶液中含有一定量的MgCl2、NaCl、MgSO4、KCl,可进一步加工制得一些重要的产品。
①将溶液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是______ __;
②过滤上述晶体后,将滤液降温到30℃以下,还会逐渐析出晶体,此晶体的主要成分_ _;
③将第②步操作得到的晶体用一定量的冷水洗涤,最后可得到比较纯净的___ __晶体。
四、(本题包括2小题,共35分)
18.(10分)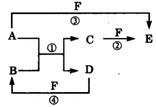 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。
(1) 若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式是 。
(2) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F、所含元素同周期,则,反应①的化学方程式是_________; B固体属于____晶体,E固体与B固体比较,______熔点高(填“B”或“E”)。
(3) 若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的结构式为________反应①和③的化学方程式分别是__________、_______________。
19.(12分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B,D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
(1) C、D组成的常见化合物,其水溶液呈碱性,原因是 ,
(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 。
(2)D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式__________ _______。
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
(4)4.0 g D单质在足量的B单质中完全燃烧,放出37 kJ热量,写出其热化学方程式: 。
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是 。
20.(13分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
| 时间 | 起始 | 14min后 | 30min后 | 75min后 |
| pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化? 为什么?
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质? 为什么此时会有沉淀析出?
五、(本题包括2小题,共22分)
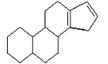 21.(10分)⑴已知:丁二烯可发生反应:CH2=CH-CH=CH2+Br2 →CH2BrCH=CHCH2Br
21.(10分)⑴已知:丁二烯可发生反应:CH2=CH-CH=CH2+Br2 →CH2BrCH=CHCH2Br
那么化合物:(如右图)
能使溴水褪色,写出其与溴发生等物质的量加成反应,可能的产物
的结构简式 , , 。
![]() ⑵苯氯乙酮是一具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:(如下图)苯氯乙酮不可能具有的化学性质是
(填充号)。
⑵苯氯乙酮是一具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:(如下图)苯氯乙酮不可能具有的化学性质是
(填充号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
 |
⑶化合物 与苯酚的关系是 。(选填字母)
A、互为同分异构体 B、互为同系物 C、均能与NaOH溶液反应 D、均属于芳香族化合物
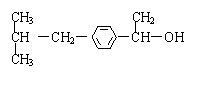
⑷药用有机化合物A为一种无色液体。从A出发可发生如图所示的一系列反应。
有机物A的结构简式为 。
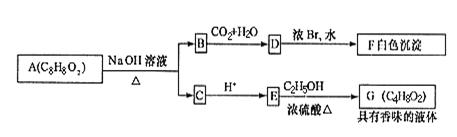
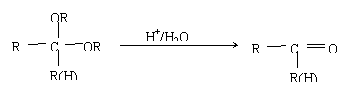 22.(12分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)
22.(12分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)
已知:
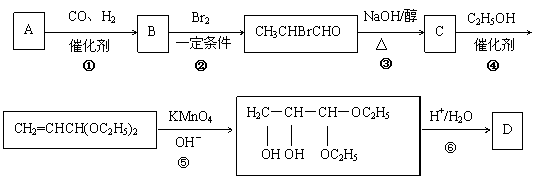
请回答下列问题:
(1)写出下列物质的结构简式:
A: ;B: ;C: ;D: 。
(2)指出反应②的反应类型 。
(3)写出反应③的化学方程式 。
(4)反应④的目的是 。
(5)化合物D′是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的
中间产物。D′在浓硫酸存在的条件下加热,既可生成能使溴水褪色的化合物E(C3H4O2),又可生成六原子环状化合物F(C6H8O4)。请分别写出D′生成E和F的化学方程式:
D′→E: 。
D′→F: 。
六、(本题包括2小题,共15分)
23.(7分)2005年12月26日是印度尼西亚苏门答腊岛附近海域发生里氏8.7级强烈地震周年纪念日。地震引发的海啸波及多个国家,已造成16万以上人员伤亡。据文献记载,预测地震的方法很多,一种是吸收法测量地下水溶解气体的量,如 CO2或氧气,然后制成曲线。为了获得溶有氧气的溶液,采用了如下方法:在250mL锥形瓶中加入25.2g焦性没食子酸 [即邻三苯酚C6H3(OH)3,难溶于水],再注入160mL21%的氢氧化钾溶液(密度为1.44g/cm3),用塞子塞好后并振荡至固体恰好完全溶解。焦性没食子酸的碱性溶液具有较强的还原能力,吸收氧气后生成(KO)3C6H2-C6H2(OK)3。试回答下列问题:
(1)160mL氢氧化钾溶液的物质的量浓度为多少?
(2)焦性没食子酸吸收氧气的化学方程式。
(3)含25.2g焦性没食子酸的碱性溶液最多能吸收氧气的物质的量?
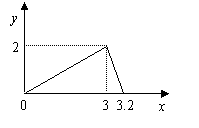
24.(8分)将总物质的量为4mol 的Na2O2和 Al2(SO4)3混合物投入足量水中,充分反应后生成y mol沉淀(y>0),若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可填满,也可不填满或补充)并作图。
| x值 | y=f(x) |
参考答案
1.D 2.D 3.D 4.C 5.C
6.B 7.BD 8.CD 9.BC 10.CD 11.B 12.B 13.AC 14.A 15.AC
16.①AD ②容量瓶(2分) ③C或CD(2分),加试剂、过滤 (每空1分)。a、d、e、h、j(2分,漏选或错选给0分)
17.(12分)⑴①4CuSO4+6NaOH===Cu4(OH)6SO4↓+3Na2SO4(2分)
②将浅绿色的浊液过滤,并把得到的绿色沉淀用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO![]() 后(2分),用足量稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶液中有大量白色沉淀生成,表示浅绿色沉淀中有SO
后(2分),用足量稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶液中有大量白色沉淀生成,表示浅绿色沉淀中有SO![]() (2分)
(2分)
⑵①MgSO4 , NaCl; ②MgCl2 , KCl; ③KCl(各2分)
18、(10分)
(1) Mg
 C+4HNO3=CO2↑+4NO2↑+2H2O
C+4HNO3=CO2↑+4NO2↑+2H2O
(2) 2C+SiO2=Si+2CO 原子晶体 B(1分)
(3) N≡N 2NH3+3Cl2=6HCl+N2 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(除标明外,其余每空2分,共15分)
19.(14分)
(1)S2—+H2O![]() HS—+OH— HSO3—+ H+
HS—+OH— HSO3—+ H+![]() H2O+SO2↑
H2O+SO2↑
(2)3S+6OH—== 2S2—+SO32— +3H2O
(3)HS—+OH—== S2—+H2O
(4)S(S)+O2(g)====SO2(g) ;△H= —296 kJ/mol
(5)负极 , O2 + 4e— + 2H2O == 4OH—
20.(9分)
⑴由于盐酸受热蒸发出HCl气体所致,随着反应的进行,盐酸逐渐与煤矸石中的物质反应而被消耗,因此,排气的pH从小逐渐变大,如果排气管加长一倍,意味着排气被冷却的程度更高,HCl更多被冷凝回流,故排气的pH有所增大。(3分)
⑵煤矸石中的铁的氧化物有Fe2O3和FeO,与酸反应首先生成较多的是二价铁盐,故呈黄绿色;由于Fe2O3逐渐溶出,加之Fe2+被氧化为Fe3+,致使溶液中Fe2+浓度逐渐降低,Fe3+浓度升高,并有部分Fe3+水解,颜色呈所述变化。(3分)
⑶沉淀物是水合硫酸钙(或硫酸钙),由于硫酸钙是微溶的,在稀BAC溶液中达到饱和,浓缩蒸发过程中变为过饱和,故形成细晶状析出。(3分)
21、(12分)
答案:
⑴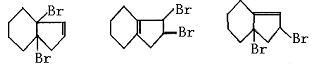
⑵ CE ⑶
D ⑷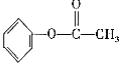 (每空2分)
(每空2分)
22.(12分)(1)A:CH2=CH2 B:CH3CH2CHO C:CH2=CHCHO D:H2C—CH—CHO
(每空1分) (2)取代反应(1分)
(3)CH3CHBrCHO+NaOH CH2=CHCHO+NaBr+H2O(2分)
(4)防止—CHO在第⑤步被氧化(1分)
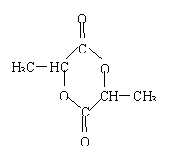
![]() (5)D′→E:H3C—CH—COOH
(5)D′→E:H3C—CH—COOH ![]() H2C=CH—COOH+H2O
H2C=CH—COOH+H2O
![]() D′→F:2H3C—CH—COOH
D′→F:2H3C—CH—COOH![]() +H2O(每空2分)
+H2O(每空2分)
23.(6分,每空2分)
(1)5.4mol/L;
(2)4C6H3(OH)3+12KOH+O2
→2(KO)3C6H2-C6H2(OK)3 + 14H2O
(3)0.05mol
24.(12分)0< x≤3;y=2x/3(4分);3<x<3.2;y=32-10x(4分)