高三化学分离与鉴别
☆双基知识
一、几种重要离子的检验
1、阳离子检验
| 离子 | 使用试剂 | 必须进行的操作 | 化学反应方程式 | 现象 |
| H+ | 石芯试液 | 将石芯试液滴入被测试液 | 溶液变红 | |
| K+ | 用铂丝或光亮的铁丝蘸取试液,在无色灯焰上灼烧 | 焰色反应 | 隔蓝色的钴玻璃观察,火焰呈紫色 | |
| Mg2+ | NaOH溶液NH4Cl溶液 | 取试液加入NaOH溶液即有白色沉淀,加过量的NaOH溶液沉淀不溶(与Al3+区别),但加NH4Cl 溶液沉淀溶解 | 2OH―+Mg2+ =Mg(OH)2 | 有白色沉淀生成,加NH4Cl 沉淀溶解 |
| Al3+ | NaOH溶液HCl溶液 | 在试液中逐滴加入NaOH 溶液,在产生的沉淀中HCl 或过量NaOH溶液,沉淀均溶解 | Al3++3OH―=Al(OH)3 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2―+2H2O | 有白色絮状沉淀生成,溶于HCl溶液或过量NaOH,不溶于水。 |
| Fe2+ | ①NaOH溶液 ②KSCN溶液 | ①在试液中加入少量NaOH溶液②在试液中加入少量KSCN溶液,振荡观察,然后加入少量新配的氯水 | ①Fe2++2OH―=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ②2Fe2++Cl2=2Fe3++2Cl― Fe3++SCN-=[Fe(SCN)]2+ | ①先生成白色沉淀,很快变为灰绿色,最后变为红褐色②KSCN溶液不变色,加氯水后变红色。 |
| Ag+ | 稀HCl 、HNO3 、 氨水 | 在试液中先加少量稀盐酸,再加硝酸,再加氨水 | Ag++Cl―=AgCl AgCl+2NH3·H2O = [Ag(NH3)2 ]+ +2H2O + Cl― | 生成白色沉淀,不溶于稀硝酸,但溶于氨水。 |
| NH4+ | NaOH溶液、红色的石芯试纸 | 在烧杯中加少量试液,加NaOH溶液,表面皿内贴一条湿润的红色石芯试纸,反盖在烧杯上,微热 | NH4++OH― = NH3↑ + H2O | 有刺激性气体放出,使湿润的红色石芯试纸变蓝。 |
2、阴离子检验
(1)OH- 能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl- 能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)Br- 能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
(4)I- 能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。
(5)SO42- 能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
(6)SO32- 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(7)S2- 能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。
(8)CO32- 能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
(9)HCO3- 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体。
(10)PO43- 含磷酸根的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸。
(11)NO3- 浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
二、有机物的检验
| 常用试剂 | 现象 | 被检验的物质可能含有的官能团 |
| 溴水 | 溴水褪色 |
|
| 白色沉淀 | 酚羟基 | |
| 酸性KMnO4 | 紫色褪去 |
|
| 银氨溶液 | 产生银镜 | —CHO |
| 新制Cu(OH)2 | 加热时,红色沉淀 | —CHO |
| 不加热时,沉淀溶解得蓝色溶液 | —COOH | |
| 石芯试液 | 变红色 | —COOH |
| 碘水 | 变蓝色 | 淀粉 |
| 浓硝酸 | 显黄色 | 含苯环的蛋白质 |
| FeCl3 溶液 | 溶液显紫色 | 酚类 |
☆巧思巧解
一、物质鉴定的一般步骤

二、物质鉴别的一般类型
1、不用任何试剂鉴别多种物质
①先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其它的几种物质。
②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来
③若以上两方法都不能鉴别时,可考虑两两混合法,记录混合后的反应现象,分析确定。
④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同,现象不同而进行鉴别
⑤若采用上述方法鉴别出一种物质后,可用它做试剂鉴别余下的其它物质。
2、只用一种试剂鉴别多种物质
①先分析被鉴别物质的水溶性、密度、溶液的酸碱性,确定能否用水或指示剂进行鉴别②常用溴水、新制氢氧化铜悬浊液、氯化铁溶液等作试剂鉴别多种有机物。
3、任先试剂鉴别多种物质
此类题型多为简答题,答题时要掌握以下要领
①选取试剂要最佳。
②不许原瓶操作。鉴别的目的是为了以后的使用,若原瓶操作,试剂污染,“别”而无用。
③不许“指名道姓”。结论的得出来自实验现象,在加入试剂之前,该物质是未知的,叙述时不可出现“取某某物质加入某某试剂……”的字样。一般简答顺序为:各取少许→溶解→ 加入试剂 → 描述现象 → 得出结论。
三、常见的分离和提纯方法
1、物理方法
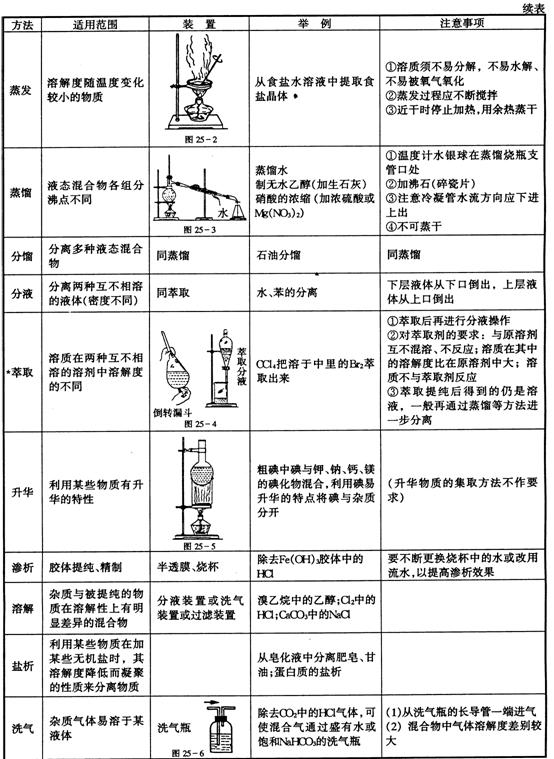
| 方法 | 适用范围 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离溶液和固体不溶物 |
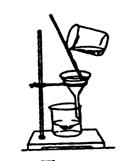
| 粗盐提纯 | ①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。②二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘。③三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和过滤器有三层滤纸处轻轻接触;漏斗颈的末端应与接受器的内壁相接触, |
| 结晶重结晶 | 一种物质的溶解度随温度变化较大,另一种物质的溶解度随温度变化较小 | KNO3中混有NaCl | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
2、化学方法——用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂。
对于无机物溶液常用下列方法进行分离和提纯:
1.生成沉淀法 例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
2.生成气体法 例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
3.氧化还原法 例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
4.正盐和与酸式盐相互转化法 例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
5.利用物质的两性除去杂质 例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。
6.离子交换法 例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2+、Mg2+进行交换,而使硬水软化。
有机物的分离和提纯
有机物的提纯要依据被提纯物质的性质,采用物理方法和化学方法除去杂质。一般情况是加入某种试剂,与杂质反应,生成易溶于水的物质,再用分液的方法除去杂质。如除去乙酸乙酯中混有的乙酸和乙醇,应在混合物中加入饱和的碳酸钠溶液,杂质乙酸与碳酸钠反应,生成了易溶于水的乙酸钠(同时降低乙酸乙酯的溶解度),充分搅拌后,用分液漏斗分液,可得纯净的乙酸乙酯。
在分离和提纯中有的的杂质不只一种,需用多种试剂和多种除杂分离方法,要注意安排好合理的除杂顺序。
四、常见的推断题的“题眼”
1、火焰颜色
(1)苍白色:H2 在Cl2 中燃烧
(2)蓝色:CO在空气中燃烧
(3)淡蓝色:CH4 、H2 在空气中燃烧
(4)金属元素的焰色反应
2、沉淀的颜色变化
(1)Fe2+:遇碱液生成沉淀,其颜色转变为:白→灰绿→红褐
(2)Ag+:遇碱液生成沉淀,其颜色转变为:白→黑
3、烟、雾
(1)在空气中出现白雾的:HCl 、HBr 、HI 、HNO3
(2)在空气中出现白烟的:NH3 + HCl 、NH3 + HNO3
(3)燃烧时出现白色烟雾的:P + Cl2
(4)燃烧时出现棕黄色烟的:Cu + Cl2
4、具有唯一现象
(1)溶于水显碱性的气体:NH3
(2)空气中无色变红棕色的气体:NO
(3)在一定条件下具有漂白性的淡黄色固体:Na2O2
((4)遇SCN- 显红色,遇苯酚显紫色,遇OH― 生成红褐色沉淀:Fe3+
(5)在空气中能自燃的固体物质:P4
(6)遇Ag+ 有沉淀,沉淀不溶于稀HNO3
若沉淀为白色:Cl-; 若沉淀为浅黄色:Br-; 若沉淀为黄色:I-;
(7)可溶于NaOH的白色沉淀为Al(OH)3,可溶于NaOH的金属氧化物:Al2O3 (ZnO )
(8)能与NaOH作用产生H2 的单质:金属为铝;非金属为硅
(9)能与新制Cu(OH)2悬浊液混合加热生成砖红色沉淀的酸性物质:HCOOH
☆例题精析
[例1]为了除去粗盐中的 Ca2+ 、Mg2+ 、SO42― 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )。 (1991年全国高考题)
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3 溶液⑤加过量BaCl2 溶液
A ①④②⑤③ B ④①②⑤③ C ②⑤④①③ D ⑤②④①③
[例2]对要除去CO2 气体中所含的少量HCI气体,最好的方法是将混合气通过( )。 (1996年试测题)
A NaHCO3 溶液 B Na2CO3 溶液 C.饱和石灰水 D氨水
【例3】下列每组各有三对物质,它们都能用分液漏斗分离的是( )。
A.乙酸乙酯和水,酒精和水,苯酚和水B.二澳乙烷和水,苯和水,硝基苯和水
C.甘油和水,乙醇和水,乙酸和乙醇 D.油酸和水,甲苯和水,已烷和水
例4仅用水就能鉴别的一组物质是( )。 (1997年上海市高考题)
A苯、乙酸、四氯化碳 B乙醇、乙醛、乙酸
C乙醛、乙二醇、硝基苯 D苯酚、乙醇、甘油
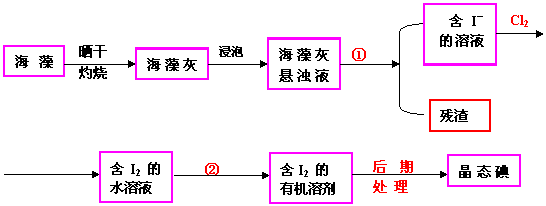 【例5 】实验室里从海藻中提取碘的流程如下图:
【例5 】实验室里从海藻中提取碘的流程如下图:
(1)
 指出制取碘的过程中有关的实验操作名称:①__________②________________
指出制取碘的过程中有关的实验操作名称:①__________②________________
(2) 提取碘的过程中,可供选择的有机试剂是______________
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(3) 为使海藻中I― 转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是_____
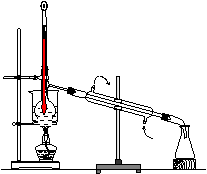
(4) 从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察上图装置,指出其中错误之处,并加以改正__________
进行上述蒸馏操作时,使用水浴的原因是______最后晶态碘在___里聚集
【参考答案】
【例1】C.D【例2】A 【例3】B.D 【例4】 A
【例5】(1)①过滤②萃取(2)B (3)漏斗、分液漏斗(4)缺石棉网;温度计的位置应将水银球置于蒸馏烧瓶支管处(5)使蒸馏烧瓶受热均匀,控制加热温度不过高;蒸馏烧瓶。