高三化学分离与鉴别
☆双基知识
一、几种重要离子的检验
1、阳离子检验:H+、Na+、K+、Mg2+、Al3+、Fe2+、Ag+、NH4+;
2、阴离子检验:OH―、Cl―、Br―、I―、SO42―、SO32―、CO32―、NO3―;
二、有机物的检验
| 常用试剂 | 现象 | 被检验的物质可能含有的官能团 |
| 溴水 | 溴水褪色 |
|
| 白色沉淀 | 酚羟基 | |
| 酸性KMnO4 | 紫色褪去 |
|
| 银氨溶液 | 产生银镜 | —CHO |
| 新制Cu(OH)2 | 加热时,红色沉淀 | —CHO |
| 不加热时,沉淀溶解得蓝色溶液 | —COOH | |
| 石芯试液 | 变红色 | —COOH |
| 碘水 | 变蓝色 | 淀粉 |
| 浓硝酸 | 显黄色 | 含苯环的蛋白质 |
| FeCl3 溶液 | 溶液显紫色 | 酚类 |
☆巧思巧解
一、物质鉴定的一般步骤

二、物质鉴别的一般类型
1、不用任何试剂鉴别多种物质
①先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其它的几种物质。
②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来
③若以上两方法都不能鉴别时,可考虑两两混合法,记录混合后的反应现象,分析确定。
④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同,现象不同而进行鉴别
⑤若采用上述方法鉴别出一种物质后,可用它做试剂鉴别余下的其它物质。
2、只用一种试剂鉴别多种物质
①先分析被鉴别物质的水溶性、密度、溶液的酸碱性,确定能否用水或指示剂进行鉴别②常用溴水、新制氢氧化铜悬浊液、氯化铁溶液等作试剂鉴别多种有机物。
3、任先试剂鉴别多种物质
此类题型多为简答题,答题时要掌握以下要领
①选取试剂要最佳。
②不许原瓶操作。鉴别的目的是为了以后的使用,若原瓶操作,试剂污染,“别”而无用。
③不许“指名道姓”。结论的得出来自实验现象,在加入试剂之前,该物质是未知的,叙述时不可出现“取某某物质加入某某试剂……”的字样。一般简答顺序为:各取少许→溶解→ 加入试剂 → 描述现象 → 得出结论。
三、常见的分离和提纯方法
1、物理方法
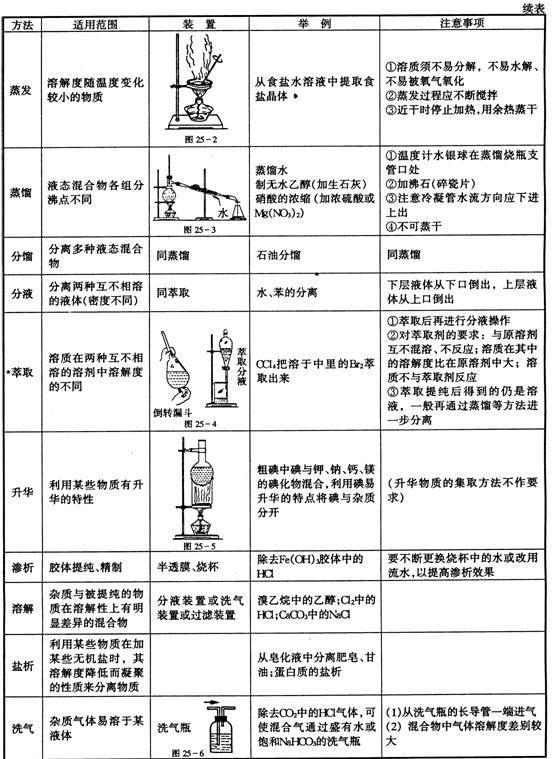
| 方法 | 适用范围 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离溶液和固体不溶物 |
| 粗盐提纯 | ①一贴,②二低,③三靠; |
| 结晶重结晶 | 一种物质的溶解度随温度变化较大,另一种物质的溶解度随温度变化较小 | KNO3中混有NaCl | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
2、化学方法——用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂。
对于无机物溶液常用下列方法进行分离和提纯:
1.生成沉淀法 例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
2.生成气体法 例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
3.氧化还原法 例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
4.正盐和与酸式盐相互转化法 例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
5.利用物质的两性除去杂质 例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。
6.离子交换法 例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2+、Mg2+进行交换,而使硬水软化。
有机物的分离和提纯
有机物的提纯要依据被提纯物质的性质,采用物理方法和化学方法除去杂质。一般情况是加入某种试剂,与杂质反应,生成易溶于水的物质,再用分液的方法除去杂质。如除去乙酸乙酯中混有的乙酸和乙醇,应在混合物中加入饱和的碳酸钠溶液,杂质乙酸与碳酸钠反应,生成了易溶于水的乙酸钠(同时降低乙酸乙酯的溶解度),充分搅拌后,用分液漏斗分液,可得纯净的乙酸乙酯。
在分离和提纯中有的的杂质不只一种,需用多种试剂和多种除杂分离方法,要注意安排好合理的除杂顺序。
四、常见的推断题的“题眼”
1、火焰颜色
(1)苍白色:H2 在Cl2 中燃烧 (2)蓝色:CO在空气中燃烧
(3)淡蓝色:CH4 、H2 在空气中燃烧 (4)金属元素的焰色反应
2、沉淀的颜色变化
(1)Fe2+:遇碱液生成沉淀,其颜色转变为:白→灰绿→红褐
(2)Ag+:遇碱液生成沉淀,其颜色转变为:白→黑
3、烟、雾
(1)在空气中出现白雾的:HCl 、HBr 、HI 、HNO3
(2)在空气中出现白烟的:NH3 + HCl 、NH3 + HNO3
(3)燃烧时出现白色烟雾的:P + Cl2
(4)燃烧时出现棕黄色烟的:Cu + Cl2
4、具有唯一现象
(1)溶于水显碱性的气体:NH3 (2)空气中无色变红棕色的气体:NO
(3)在一定条件下具有漂白性的淡黄色固体:Na2O2
((4)遇SCN- 显红色,遇苯酚显紫色,遇OH― 生成红褐色沉淀:Fe3+
(5)在空气中能自燃的固体物质:P4 (6)遇Ag+ 有沉淀,沉淀不溶于稀HNO3
若沉淀为白色:Cl-; 若沉淀为浅黄色:Br-; 若沉淀为黄色:I-;
(7)可溶于NaOH的白色沉淀为Al(OH)3,可溶于NaOH的金属氧化物:Al2O3
(8)能与NaOH作用产生H2 的单质:金属为铝;非金属为硅
(9)能与新制Cu(OH)2悬浊液混合加热生成砖红色沉淀的酸性物质:HCOOH
☆例题精析
[例1]为了除去粗盐中的 Ca2+ 、Mg2+ 、SO42― 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )。 (1991年全国高考题)
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3 溶液⑤加过量BaCl2 溶液
A ①④②⑤③ B ④①②⑤③ C ②⑤④①③ D ⑤②④①③
[例2]对要除去CO2 气体中所含的少量HCI气体,最好的方法是将混合气通过 A NaHCO3 溶液 B Na2CO3 溶液 C.饱和石灰水 D氨水
【例3】下列每组各有三对物质,它们都能用分液漏斗分离的是( )。
A.乙酸乙酯和水,酒精和水,苯酚和水B.二澳乙烷和水,苯和水,硝基苯和水
C.甘油和水,乙醇和水,乙酸和乙醇 D.油酸和水,甲苯和水,已烷和水
例4仅用水就能鉴别的一组物质是( )。 (1997年上海市高考题)
A苯、乙酸、四氯化碳 B乙醇、乙醛、乙酸
C乙醛、乙二醇、硝基苯 D苯酚、乙醇、甘油
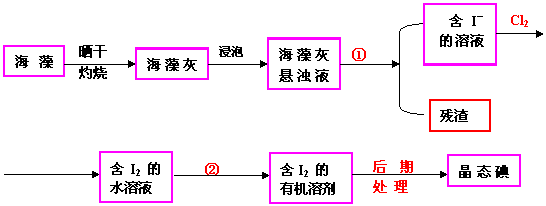 【例5 】实验室里从海藻中提取碘的流程如下图:
【例5 】实验室里从海藻中提取碘的流程如下图:
(1)
 指出制取碘的过程中有关的实验操作名称:①__________②________________
指出制取碘的过程中有关的实验操作名称:①__________②________________
(2) 提取碘的过程中,可供选择的有机试剂是______________
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(3) 为使海藻中I― 转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是_____
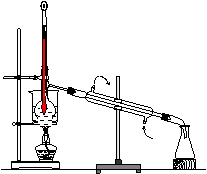
(4) 从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察上图装置,指出其中错误之处,并加以改正__________
进行上述蒸馏操作时,使用水浴的原因是______最后晶态碘在___里聚集。
【参考答案】
【例1】C.D【例2】A 【例3】B.D 【例4】 A
【例5】(1)①过滤②萃取(2)B (3)漏斗、分液漏斗(4)缺石棉网;温度计的位置应将水银球置于蒸馏烧瓶支管处(5)使蒸馏烧瓶受热均匀,控制加热温度不过高;蒸馏烧瓶。