高三化学测试(2)
可能用到的原子量:H=1 C=12 N=14 O=16 Na=23 Mg=24 S=32 Cl=35.5 Zn=65 Fe=56 Al=27 Ag=108 Cu=64 P=31 K=39 Ca=40
第Ⅰ卷(选择题共67分)
一、选择题:(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.我国已经规定2005年在冰箱生产中全面停止使用氟里昂(如CCl3F、CHClF2等)作致冷剂。该致冷剂确有许多优点,但又具有破坏大气臭氧层的严重缺点。据研究产生这一缺点的原因在于它们的组成中含有
A、氟元素 B、氢元素 C、氯元素 D、碳元素
2. 意大利科学家最近合成一种新型氧分子,它由4个氧原子构成,专家认为它液化后的能量密度比普通氧分子高得多,下列关于该分子叙述正确的是
A.它是氧元素的另一种同位素
B.它将成为一种新型强力火箭推进燃料
C.它的摩尔质量是64
D.它是氧气的另一种同素异形体
3. 实验台上有下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、滤纸、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,不能进行的实验操作是
A.蒸发 B.萃取 C.过滤 D.蒸馏
4. 已知H2(气)+![]() O2(气)=H2O(气);△H=-242KJ/mol
O2(气)=H2O(气);△H=-242KJ/mol
H2(气)+![]() O2(气)=H2O(液);△H=-286kJ/mol
O2(气)=H2O(液);△H=-286kJ/mol
若将标准状况下的H2和O2混合气点燃后,再恢复到原状况时,气体体积减少3.36L,则反应放热为 A.24.2kJ B.28.6kJ C.57.2kJ D.72.6kJ
5. 下图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是
|
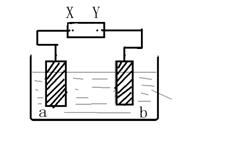 |
| a极板 | B极板 | X电极 | Z溶液 | |
| (A) | 锌 | 石墨 | 负极 | CuSO4 |
| (B) | 石墨 | 石墨 | 负极 | NaOH |
| (C) | 银 | 铁 | 正极 | AgNO3 |
| (D) | 铜 | 石墨 | 负极 | CuCl2 |
6.在V升Fe2(SO4)3溶液中加入过量的氨水,过滤得沉淀,然后在高温下灼烧沉淀,最后得到棕红色固体m克,则原溶液中的SO42-的物质的量的浓度是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7.碳正离子[例如CH3+、CH5+,(CH3)3C+]是有机反应的中间体。CH3+中4个原子是共平面的,且3个键角相等。下列判断不正确的是
A. 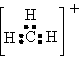 CH3+的电子式是
CH3+的电子式是
B. CH5+失去H2可得CH3+
C. CH5+失去H可得CH4
D. CH3+的键角为1200
8.下列说法正确的是
A.晶体中含有金属元素的离子都是阳离子
B.晶体中有阴离子就一定有阳离子
C.固态HF、HCl、HBr、HI都是分子晶体,熔沸点HF<HCl<HBr<HI
D.在SiO2晶体中,每个Si原子与2个氧原子形成极性键
9. 将40℃的饱和石灰水在温度不变的情况下加入少量CaO,下列说法不正确的是
A.Ca(OH)2的质量分数不变 B. Ca2+的物质的量浓度不变
C.pH值增大 D.溶液中Ca(OH)2的物质的量减少
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题为0分。)
10. 等质量的N2和CO中所含:①物质的量,②体积,③分子数,④原子数.其中相等的是 A.①② B.③④ C.①③④ D.①②③④
11.下列各种说法正确的是
A. 将25克CuSO4·5H2O溶于1升水中可制备0.1摩/升硫酸铜溶液
B.同温同压下等体积的SO2和SO3所含硫原子个数相等
C. 1mol Na2O2与足量二氧化碳反应,可转移的电子数为NO
D. 1mol甲基(-CH3)中,原子核外存在9NA个电子
12. 设NA表示阿伏加德罗常数,下列说法正确的是
A.80g硝酸铵含有氮原子数为2NA
B.标准状况下,11.2L四氯化碳所含的分子数为0.5 NA
C.在铜与硫的反应中,1mol铜失去的电子数为2NA
D.1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA
13. 两个体积相同的容器,一个盛有甲烷,另一个盛有氖气和氨气,在同温同压下两容器内的气体一定具有相同的
(A)原子总数(B)质子总数(C)分子总数(D)质量
14.下列反应的离子反应方程式中,书写正确的是
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C. 向氨水中通入过量二氧化碳: NH3·H2O+CO2=NH4++ HCO3-
D.FeBr2溶液与等摩尔Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
|
16.下列化学式只能代表一种物质的是
A. CF2Cl2 B. P C. C2H6O D. NH2CH2COOH
17. 在20℃l.03×105Pa下,将三个分别盛满按4∶3混合而成的气体①NH3和O2②HCl和O2③NO和O2的烧瓶,分别倒置于盛水的水槽中,当水进入烧瓶,并使气体充分溶解后,假定烧瓶内溶液无损失,所得溶液的物质的量浓度之比是
A.1:1:1 B.5:5:4 C.7:7:4 D.1:1:2
18. 某溶液c(H+)=10–2mol/L,则此溶液中不能大量共存的离子组是
A、Br–、Cl–、NH4+、Mg2+ B、Na+、K+、NO3–、Cl–
C、K+、Ba2+、I–、NO3– D、AlO2—、Na+、Cl–、SO42–
19. 现有pH=2的盐酸与pH=12的氨水等体积混合,混合后溶液中各离子浓度关系正确的是
(A)C(Cl-) >C(NH4+)>C(H+)>C(OH-)
(B)C(NH4+)>C(Cl-)>C(OH-)>C(H+)
(C)C(NH4+)=C(Cl-)>C(OH-)=C(H+)
(D)C(NH4+)+C(H+)=C(Cl-)+C(OH-)
第二卷(非选择题共83分)
三.(本题有二小题共24分)
20.(10分)实验室用下图所示装置进行苯与溴反应的实验。
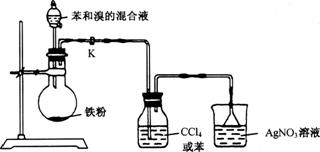
请回答下列问题:
(1)若装置中缺洗气瓶,则烧杯中产生的现象无法说明苯与溴的反应是取代反应,理由是____________ 。
(2)反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢,可通过以下操作除去: ①水洗; ②碱洗; ③水洗; ④干燥; ⑤……。
其中,操作②碱洗的目的是 完成操作④干燥后,接下来的操作⑤是 (填操作名称)。
(3)如果省略(2)中的操作①,一开始就进行碱洗,会对后面的操作造成什么影响?(简要说明理由)____________________________________ 。
21.(14分)已知FeS0![]() 在高温下分解生成Fe
在高温下分解生成Fe![]() O
O![]() 、S0
、S0![]() 和SO
和SO![]() 。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0
。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0![]() 的质量。
的质量。
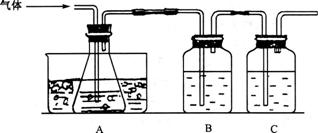
请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是________________________________________________。
(2)A瓶内所盛试剂的作用是___________ __,A瓶要用冰水冷却的原因是_________________________________________________________________。
(3)检验后,用A瓶内的混合物测定FeS0![]() 已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a![]() g,再次灼烧冷却至室温称量其质量为a
g,再次灼烧冷却至室温称量其质量为a![]() g,且a
g,且a![]() <a
<a![]() ,接下来的操作应当是_____________________________________________________________
。
,接下来的操作应当是_____________________________________________________________
。
(5)已经分解的FeS0![]() 的质量是___________ (填计算式)。
的质量是___________ (填计算式)。
四、(本题包括2小题,共20分。)
22.(10分)现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。 为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50 mg碘酸钾。回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒。请简述其中所包含的化学原理 。
(2)KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液。总反应方程式为:KI+3H2O = KIO3+3H2↑(条件:电解),则两极的电极反应式分别为:阴极 ;阳极 。
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428 g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为 。为进一步确证该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:I2+2S2O2-3 = 2I-+S4O2-6),由此通过计算可判断该加碘食盐为 (填“合格”或“不合格”)产品。
23.(10分)A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液跟石炭酸溶液混合,溶液呈紫色。A~L各物质之间相互反应转化关系如下图所示:
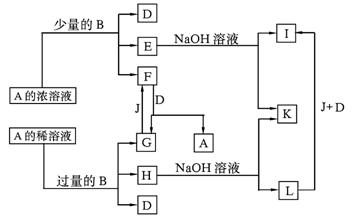
请回答:
(1)B在A的浓溶液中反应而溶解的条件是 ,而常温下B在A的浓溶液中难以反应而溶解的原因是 。
(2)写出下列化学方程式:
F→G+A ;G→F ;
E→I的离子方程式 。(3)L转化成I的现象是 。
五.(共二题,20分)
24.(10分)右下图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在
![]()
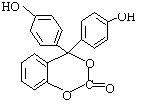 催化加氢过程中不变,其反应原理如下:
催化加氢过程中不变,其反应原理如下:
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
⑴该有机物的的化学式为 。
⑵该有机物分子中的三个苯环________________共平面(选填“能”或“不能”)。
⑶1mol该有机物在铜铬氧化物催化下能与 mol氢气充分反应。
⑷该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量最小的钠盐的化学式为 。
25.(10分)卤代烃R—C1在一定条件下可发生如下反应:
| |||
![]()
![]() R—C1
+ H2O
ROH+HCl R—C1 + KCN
R—CN
+ KCl
R—C1
+ H2O
ROH+HCl R—C1 + KCN
R—CN
+ KCl
R—CN
+ 2H2O + H+![]() R—COOH
+ NH
R—COOH
+ NH![]()
以乙烯为原料经过下图所示的反应可制取有机物W(A、B、C、D、E均为烃的衍生物) 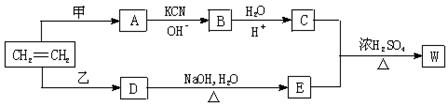
⑴若甲为Cl2 ,乙为HCl ,生成物W的分子式为C8H14O4 ,则W的结构简式为
__________________________________________________________
⑵若甲、乙均为C12,生成的W为最小环状分子,写出C
+ E![]() W的化学方程式
。
W的化学方程式
。
⑶若甲、乙均为C12,生成的W为高分子,则W的结构简式为
⑷若W的分子式为C5H10O3则甲为________________,乙为__________。
六、(本题包括2小题,共19分)
26.(8分)6.4gCu与过量硝酸(a mol / L,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
⑴此时溶液中所含NO3-为 mol。
⑵求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
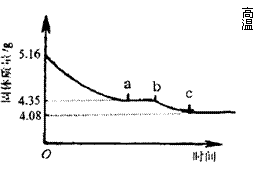
27.(11分)某化学研究性学习小组在研究某结晶水合物(MSO4·2H2O)的过程中,做了如下实验:将含结晶水合物放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下表。
| 实验顺序(按延长加热时间) | 固体质量/g | |
| 加热前(g) |
| |
| 1 | 5.16 | 4.89 |
| 2 | 4.68 | |
| 3 | 4.35 | |
| 4 | 4.35 | |
| 5 | 4.20 | |
| 6 | 4.17 | |
| 7 | 4.08 | |
| 8 | 4.08 | |
(注:在上述实验温度下,MSO4不分解)
利用数据可绘制成如右图所示的图像:
(1) 利用实验数据,通过计算确定M元素的相对原子质量,并写出其元素符号。
⑵ 求ab段坩埚中固体物质的化学式。
参考答案(1-19题见选择题红色选项)
20.(1)溴与AgN0![]() 溶液反应生成AgBr沉淀,无法确定溴与苯反应有HBr生成
溶液反应生成AgBr沉淀,无法确定溴与苯反应有HBr生成
(2)除去粗溴苯中的溴和溴化氢,蒸馏(或分馏)
(3)先用碱洗,溴化铁与碱反应生成氢氧化铁沉淀,很难分离。
21.(1)BaCl![]() ,吸收S0
,吸收S0![]() (
(2)检验并吸收S0
(
(2)检验并吸收S0![]() ,SO
,SO![]() 与H
与H![]() 0反应放出大量的热
0反应放出大量的热
(3)向A瓶中逐滴滴加BaCl![]() 溶液,直至不再产生新的沉淀。
溶液,直至不再产生新的沉淀。
(4)继续灼烧、冷却、称重,直至连续两次称量的质量不变。
(5) ![]() ×152×2g(a
×152×2g(a![]() g是最后一次称量的质量)
g是最后一次称量的质量)
22. (1)KIO3在加热或高温下易分解而变质
(2)6H2O+6e-=3H2↑+6OH-
I-+3H2O-6e-=IO-3+6H+
(3)5I-+IO-3+6H+=3I2+3H2O 合格
23.(1)加热 钝化
(2)3NO2+H2O=2HNO3+NO 2NO+O2=2NO2
Fe3++3OH-=Fe(OH)3↓
(3)白色沉淀先变成灰绿色,最后变成红褐色
24.⑴C20H14O5 ⑵不能 ⑶3 ⑷Na2CO3
25.⑴CH3CH2OOCCH2CH2COOCH2CH3
⑵HOOCCH2CH2COOH+HOCH2CH2OH![]()
![]()
![]() ⑶ [OCCH2CH2COOCH2CH2O
] n
⑶ [OCCH2CH2COOCH2CH2O
] n
⑷ HCl Cl2
26.⑴0.3
⑵设生成气体中NO2、NO的物质的量分别为X mol、Y mol
由得失电子守恒:X+3Y=0.2mol
由“N”元素守恒:X+Y=(0.03a-0.3)mol
X=(0.045a-0.55)mol;
Y=(0.25-0.015a)mol。
(其他合理解法也给分)
27.解:根据表格和图中所示,提取有用数据:
⑴MSO4·2H2O![]() MSO4+2H2O
MSO4+2H2O
M+96+56 36
5.16g 1.08g
M=40 该元素的相对原子质量为40,元素符号为Ca.
⑵CaSO4·2H2O![]() CaSO4·yH2O+(2-y)H2O
CaSO4·yH2O+(2-y)H2O
172 136+18y
5.16g 4.35g
y=![]()
该化合物为2CaSO4·H2O(或CaSO4·![]() H2O)。。
H2O)。。
 加热后(g)
加热后(g)